Современный этап развития медицины характеризуется появлением новых экспери- ментальных и клинических фактов, отражающих многочисленные особенности системной гемодинамики. Работы, посвященные периферическому кровообращению, составляют важный раздел кардиологической науки и практики и иллюстрируют значимость системы гемоциркуляции как целостно функционирующего элемента.
Периферический фактор кровообращения тщательно изучен профессором М. В. Яновским. Он и его сотрудники сформулировали гипотезу о существовании «периферического сердца» — активного гемодинамического фактора, способствующего пери- ферической гемоциркуляции. В дальнейшем официальные анатомические и физиологические каноны исключили возможность наличия в организме периферического сердца. Тем не менее возвращаясь к теории М. В. Яновского и рассматривая ее с позиций современной экспериментальной и практической кардиологии, обладая новыми инструментальными возможностями изучения центрального и периферического кровообращения, мы вновь и вновь задаем себе вопрос: действительно ли существует в организме человека «некий орган» или комплекс анатомо-физиологических условий, который можно было бы назвать периферическим сердцем?
Теория «периферического сердца» появилась в результате того, что господствовавшая теория Генле, согласно которой сердце является единственным «мотором» для продвижения крови, не давала удовлетворительного объяснения многим явлениям кровообращения. Считалось, что сосуды только распределяют кровь по областям тела, причем различие в кровенаполнении их определяется изменениями сосудистого тонуса. Однако только лишь колебаниями сосудистого тонуса трудно было объяснить очень многие явления, наблюдающиеся в эксперименте и в клинике: компенсаторное развитие гладкомышечных элементов того или иного отдела кровеносной системы при гипоплазии медии в других отделах; активная сосудистая перистальтика у многих низших животных, не имеющих сердца (annelides), служащая для передвижения крови; наличие у сосудов высших животных спонтанных ритмических сосудистых сокращений.
На важную роль периферической артериальной системы в кровообращении указывал С. П. Боткин еще в 1875 г. Допуская наличие ритмических изменений сосудистого тонуса, он писал: «Возможно, что ритмические сокращения сосудов обусловливаются именно попеременной ритмической деятельностью сосудодвигательных и сосудоугнетающих нервных аппаратов, что и составляет, таким образом, большую аналогию между иннервацией сосудов и иннервацией сердца, в веществе которого находятся нервные узлы, возбуждающие сокращения сердечной мышцы, и узлы, задерживающие эти движения». Развивая идеи своего учителя, М. В. Яновский определил периферическое сердце как «ритмические изменения артериального тонуса перистальтической природы, распространяющиеся к периферии и помогающие сердцу в его пропульсивной работе».
Основными доказательствами теории «периферического сердца» явились многочисленные факты того, что периферическое артериальное русло имеет автономную активность по изменению сосудистого тонуса. Так, было отмечено, что при сужении сосудов наступает усиление сосудистой перистальтики, подобно тому, как усиление кишечной перистальтики находится в зависимости от стеноза кишок. С. П. Заводская отмечала различные степени сосудистого напряжения в разные моменты прохождения пульсовой волны с преобладанием напряжения в диастолической части. Преобладание тонуса диастолической части при сдавлении вышележащего участка артерии — «подавляется первая систолическая волна и оказываются выше диастолические волны; пульс принимает твердые формы, несмотря на уменьшенное при этом наполнение сосуда», — описывал Н. А. Куршаков [1, 2]. Повышение периферического давления под манжеткой при измерении высоты периферического давления отмечали А. А. Миллер и А. Л. Мясников (1926).
К сожалению, экспериментальные и клинические работы по значению периферического звена системной гемодинамики не имели существенного развития, результатом чего явилось возрождение первостепенной значимости сердца как насоса и предание забвению идеи «периферического сердца» на многие годы.
Тем не менее систематизация разрозненного клинического и экспериментального материала, накопленного за последние десятилетия, позволяет сделать вывод, что активные периферические гемодинамические факторы все же существуют. Статистика недавних лет свидетельствует о том, что средняя мощность сердца человека за одно сокращение в состоянии покоя не превышает 1–3,3 Вт. Столько энергии потребляет лампочка карманного фонарика. Не ясно, как этот маломощный насос совершает колоссальную работу, перекачивая за сутки 7,2 т крови, за год 2688 т. Согласно расчетам Е. Г. Коновалова и Д. Л. Кан (1974) [3] при отсутствии на уровне капилляров гемодинамического механизма типа ультразвукового капиллярного эффекта сердце должно быть в 40 раз мощнее. Если смоделировать сосудистое русло из стекла, то для его перфузии водой потребуется насос мощностью не менее 100–150 Вт [4]. По расчетам некоторых авторов для искусственного сердца, не связанного функционально с артериальной системой, необходим механический привод мощностью не менее 25 Вт, иначе адекватное кровообращение через живую регулируемую сосудистую систему невозможно [5].
В этой связи требует объяснения главное противоречие: «Мощность сердца слишком мала в сравнении с той огромной работой, которую оно выполняет».
Задавая себе вопрос относительно перечня элементов периферической гемодинамики, активно участвующих в продвижении крови, можно отметить, что такими факторами являются: крупные артерии (как эластического, так и мышечного типа); артерии среднего и мелкого калибра; венозное русло (венозная «помпа»), комплекс органов, участвующих в дыхании; мышечная система. Вероятное регулирующее значение относительно активной периферической гемодинамики имеет эндотелий. Доказательствами весомой роли эндоте- лия в системной гемодинамике служат научные свидетельства наличия у эндотелиальной выстилки сосудов многочисленных функций (вазорегуляторной, секреторной, барьерной, защитной, гемореологической и др.).
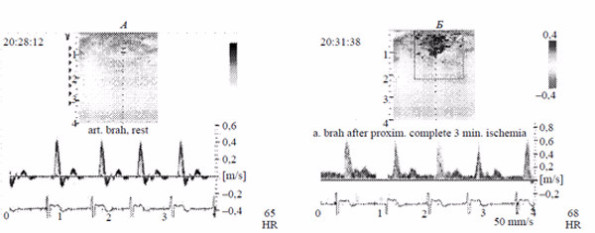
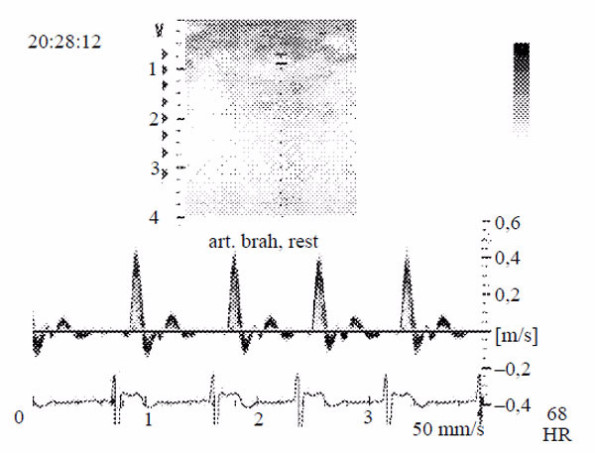
Рис. 1. Допплерографическое исследование кровотока в плечевой артерии до (А) и после (Б) ишемиче- ской пробы. Выше изолинии кровоток направлен антеградно, ниже изолинии — ретроградно.
Убедительно роль эндотелия может быть представлена при сравнении характера периферического кровотока до и после локальной ишемии. Так, вне ишемического воздействия кровоток в диастолу имеет пульсирующий характер (несколько антеградных — от центра к периферии и ретроградных — от периферии к центру — волн), а после кратковременного периода ишемии диастолическая фаза кровотока существенно увеличивается, формируется только антеградный вариант продвижения крови (рис. 1).
Хорошей иллюстрацией значимости эндотелия в системном кровообращении служат клинические наблюдения Н. А. Шпилькиной [6] о взаимосвязи структурного ремоделирования сосудистой стенки и эндотелиальной дисфункции (рис. 2) и взаимозависимости процессов эндотелий-зависимой релаксации и ремоделирования сердца (рис. 3).
Таким образом, эндотелий, несомненно, претендует на роль активного и самостоятельного фактора, регулирующего не только периферическое, но и центральное кровообращение.
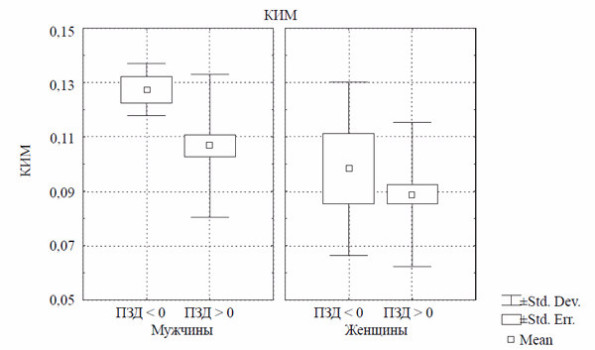
Рис. 2. Взаимосвязь толщины комплекса интима-медиа (КИМ, мм) и поток-зависимой дилатации (ПЗД, %).
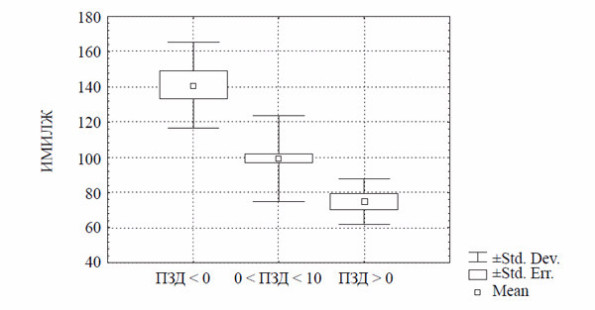
Рис. 3. Взаимосвязь индекса массы миокарда левого желудочка (ИММЛЖ, г/мм2) и поток-зависимой дилатации (ПЗД, %).
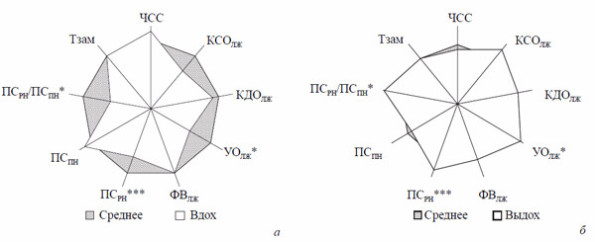
Вторым весомым элементом, регулирующим гемоциркуляцию, можно считать венозное русло. Приводя доказательства важности венозных сосудов в системном кровообращении, можно отметить, что объем сердечного выброса составляет всего около 80 мл, в то же время объем крови венозного русла — 2000 мл. Следовательно, для того чтобы полностью наполнить сердце из венозного депо крови, достаточно изменить средний диаметр вен меньше чем на 3 %! Краткой иллюстрацией значимости венозного притока в регуляции центральной гемодинамики служат результаты А. Г. Обрезана [7]) (рис. 4).
Существенное изменение внутрисердечных объемов и скоростей внутрисердечного кровотока при колебаниях венозной составляющей гемодинамики позволяет сделать заключение о значительной роли венозных сосудов в системном кровообращении.
Не менее значимое влияние на центральную гемодинамику оказывает и комплекс органов дыхания. Действительно, кровь из капилляров, давление в которых не более 10–20 мм рт. ст., поднимается к сердцу на высоту 50–100 см и более, преодолевая давление венозного столба в 40–80 мм; и весьма вероятно, что вспомогательное значение в этом процессе имеют ритмические колебания внутригрудного давления. На рис. 5 приведены данные, указывающие на значимость фаз вдоха и выдоха в центральной гемодинамике [8].
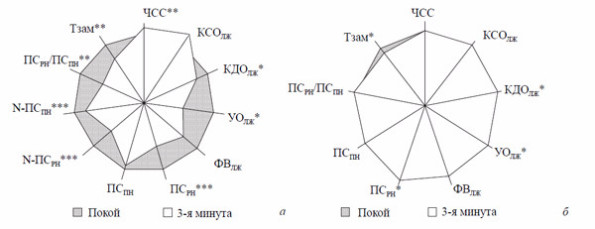
Рис. 4. Изменения внутрисердечной гемодинамики у больных при ортостатической (а) и антиортостатической (б) пробах .
ЧСС — частота сердечных сокращений; КСОЛЖ — конечный систолический объём ЛЖ; КДОДЖ— конечный диастолический объём ЛЖ; УОЛЖ — ударный объём ЛЖ; ФВЛЖ— фракция выброса ЛЖ; ПСРН— пиковая скорость раннего наполнения ЛЖ; ПСПН — пиковая скорость позднего наполнения ЛЖ; ПСРН/ПСПН — соотношеник пиковых скоростей раннего и позднего наполнения ЛЖ; Тзам— время замедления кровотока фазы раннего наполнения;*р<0,05, **p<0,01, ***p<0,001.
Рис. 5. Изменения внутрисердечной гемодинамики на вдохе (а) и выдохе (б) (обозначения те же, что и на рис. 4). *p<0,05; ***p<0,001.
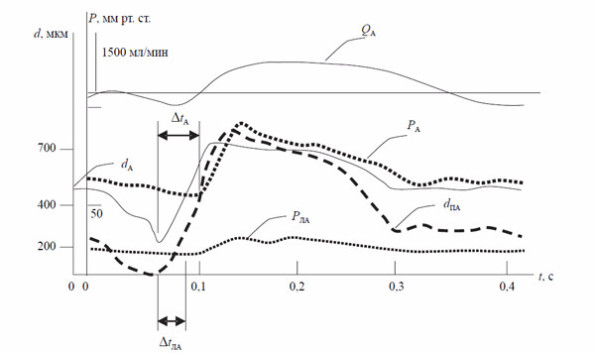
И все же наиболее значимую позицию среди элементов периферического кровообращения, на наш взгляд, имеет артериальное русло. На существенное значение периферического звена кровообращения указывают многие авторы [9–12]. Наиболее интересными в контексте нашей статьи представляются данные [13, 14] о том, что артерии обладают не только активными механическими, но и электрическими свойствами; пульсовая волна в артериальной системе представляет собой солитон, который распространяется от сердца на периферию, не угасая благодаря механизму предварительного активного расширения артерий, опережающего волну давления на 0,02–0,04 с в большом круге и на 0,06–0,12 с — в малом круге кровообращения (рис. 6).
Рис. 6. Осциллограмма. Диаметральные деформации аорты и в легочной (dA) и легочной артерии (dЛА); динамика изменений давлений в аорте (РА) и в лёгочной артерии (РЛА); объемный расод крови в аорте QА.
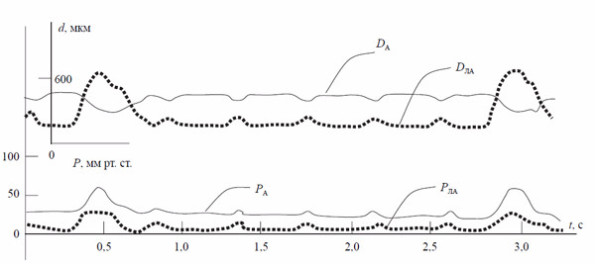
Рис. 7. Сократительно-дилататорная деятельность грудной аорты (DA и PA) и лёгочной артерии (DAЛ и PAЛ), синхронная с сокращениями предсердий при поперечной блокаде сердца: диаметрально расположенные тензодатчики регистрируют синхронные с систолой предсердий сокращения грудной аорты и легочного ствола в период асистолии желудочков.
Управляющим центром для такой активной перистальтической сосудистой волны, предваряющей сосудистый ударный объем, по мнению В. Д. Ивановой и соавт. [13, 14], может являться синусовый узел.
Еще одним свидетельством приведенным теоретическим и экспериментальным положениям служат данные о соответствии сократительно-дилататорной деятельности грудной аорты и легочной артерии и сокращений предсердий при поперечной блокаде сердца [13] (рис. 7).
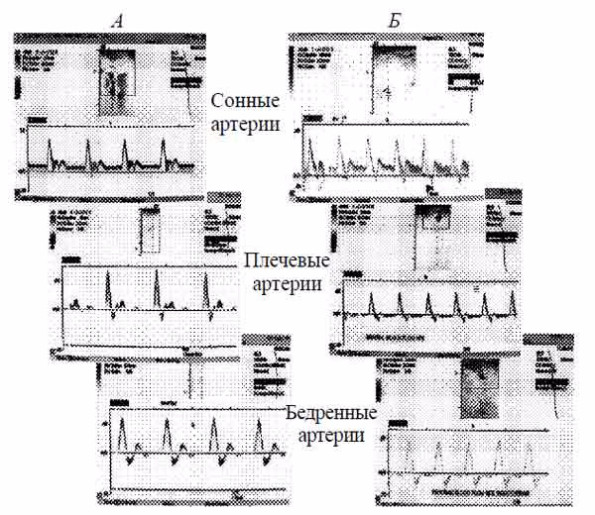
Не менее интересны сравнения вариантов периферического кровотока у здоровых испытуемых и больных сердечной недостаточностью. Создается впечатление отчетливо выраженной ретроградной (в периферических артериях) или сниженной антеградной (в брахиоцефальных артериях) предсистолической фазы кровотока у больных хронической сердечной недостаточностью (ХСН) (рис. 8).
Рис 8. Допплерографические образцы кровотока у здоровых обследованных (А) и у больных ХСН (Б).
Такой механизм создает облегченные артерии условия снижения конечного диастолического давления перед каждой последующей систолой, увеличивая градиент давления от центра к периферии последовательно в каждом сегенте сосуда.
Возвращаясь к особенностям периферического кровотока, хочется обратить внимание читателя на рис. 9.
Рис. 9. Допплерографический вид кровотока в плечевой артерии.
Бедренные артерии после электрокардиографического периода систолы регистрируется антеградный систолический пик основного кровотока, определяющий ударный объем в данном сосуде. За систолическим пиком следуют несколько антеградных и ретроградных пиков кровотока, чередующихся друг с другом. Ясно, что минутный объем кровотока через поперечное сечение сосуда определяется в основном систолическим пиком, однако суммарный вклад вторич- ных антеградных пиков также имеет немаловажное значение в кровоснабжении тканей. Интересен тот факт, что диастолический про- пульсивный кровоток не зависит, в известной степени, от систолического, а определяется эластическими свойствами сосуда, колебаниями градиента давлений в каждом сегменте, периферическим сосудистым сопротивлением. Перечисленные факторы, очевидно, и составляют существо «периферического сердца». Кроме того, хотим обратить внимание читателей на высокую межиндивидуальную гетерогенность периферического кровотока, а также на его зависимость от многочисленных факторов: физической активности, артериального давления, температуры, — число пиков, их направленность, амплитуда и последовательность могут быть различными у одного и того же человека в одном и том же сосуде при различном состоянии организма.
Приведенные экспериментальные и клинические наблюдения имеют не столько научное, сколько прикладное значение. В связи с вышеизложенными данными особое значение приобретает вопрос о целесообразности использования нового для России нозологического термина «сердечная недостаточность» вместо синдромального выражения «недостаточность кровообращения». Данные [15] свидетельствуют о наличии симптомов сердечной недостаточности по NYHA 1 ФК у 44 % и 2 ФК у 18 % больных с фракцией выброса более 50 %! С другой стороны, отсутствие симптомов сердечной недостаточности встречается у больных с фракцией выброса <50 % более чем в 32 % случаев. Таким образом, не только сердечная несостоятельность, но и другие факторы могут играть существенную роль в формировании клинической картины, которую лучше определить как недостаточность кровообращения. Наши клинические наблюдения свидетельствуют о наличии особенностей формы, величины и продолжительности отдельных фаз внутрисосудистого кровотока у больных ХСН по сравнению с таковыми у больных без систолической дисфункции.
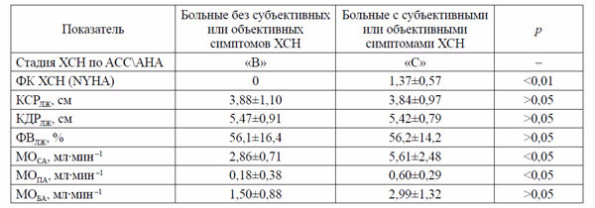
Проанализировав состояние внутрисердечной (объемные и скоростные характеристики внутрисердечного кровотока), центральной (морфометрические данные сердца, объемные и скоростные характеристики кровотока в аорте и легочной артерии) и периферической (морфометрия крупных артериальных сосудов, объемные и скоростные характеристики внутрисосудистого кровотока) гемодинамики на большом массиве больных (750 человек) с проявлениями сердечной недостаточности стадий «А», «В», «С» и «D» (АСС\АНА, 2002), мы пришли к заключению, что пациенты со стадией «В» (наличие ремоделирования сердца и отсутствие симптомов ХСН) и пациенты со стадией «С» (наличие симптомов ХСН при подлежащих патологии и ремоделировании сердечно-сосудистой системы) не имеют статистических различий между собой по показателям центральной гемодинамики, но достоверно различаются по отдельным показателям периферического кровотока (табл 1).
Таблица 1. Сравнительная характеристика показателей центральной и периферической гемодинамики у больных кардиологическими заболеваниями с симптомами ХСН и без симптомов ХСН (M±m)
Примечание. Здесь и в табл. 2: ФК ХСН — функциональный класс хронической сердечной недостаточности; КСРЛЖ — конечный систолический размер левого желудочка; КДРЛЖ — конечный диастолический размер левого желудочка; ФВЛЖ — фракция выброса левого желудочка; МОСА — минутный объем кровотока через поперечное сечение сонных артерий; МОПА — минутный объем кровотока через поперечное сечение плечевых артерий; МОБА — минутный объем кровотока через поперечное сечение бедренных артерий. M — среднее арифметическое, m — ошибка определения среднего значения.
Полученные результаты свидетельствуют о том, что факт появления симптома ХСН может не зависеть от состояния сердца и более вероятно определяется условиями периферического кровообращения. То есть при равном снижении пропульсивной деятельности сердца симптомы недостаточности кровообращения могут наблюдаться или не отмечаться, что, вероятно, зависит от различных способностей артериального русла по доставке крови от сердца к периферии и от возможностей венозного русла по воз- врату крови к сердцу.
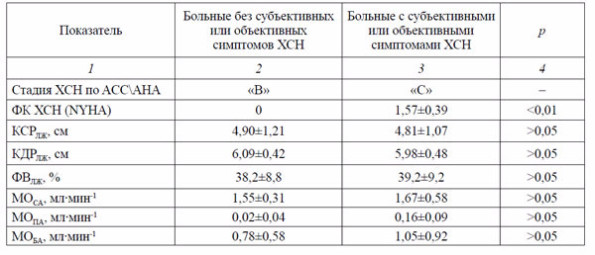
Необходимо отметить, что недостаточность сократительной деятельности сердца может успешно компенсироваться не только макрогемодинамическими параметрами, но и условиями микроциркуляции или тканевого метаболизма. В подтверждение этого положения можно привести наши данные по сравнительной характеристике показателей центральной и периферической гемодинамики у больных с симптомами ХСН (стадия «С» АСС\АНА) и без субъективных или объективных проявлений ХСН (стадия «В» АСС\АНА). Следует подчеркнуть, что все больные, включенные в математический анализ, имели низкую фракцию выброса (табл. 2).
Таблица 2. Сравнительная характеристика показателей центральной и периферической гемодинамики у больных кардиологическими заболеваниями с симптомами ХСН и без симптомов при равновеликом снижении фракции выброса ХСН (M±m)
Полученные результаты подтверждают наше предположение, что существенно измененные условия центральной и периферической гемодинамики могут быть компенсированы на тканевом уровне. По нашему мнению, вероятными факторами, участвующими в формировании субъективных или объективных проявлений ХСН, могут быть: пороговые особенности восприятия нарушений гемодинамики, уровень микроциркуляции, функция вегетативной нервной системы, характер тканевого метаболизма, клеточной регенерации и репарации.
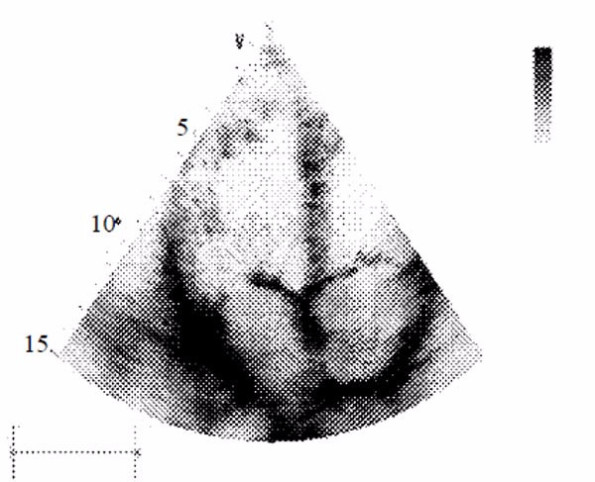
Определенный интерес представляют практические наблюдения о возможной приспособительной асинхронности сокращений и расслаблений левых и правых отделов сердца с опережением левым желудочком правого. На рис. 10 представлена не описываемая в классической физиологии фаза деятельности сердца, когда один из атриовентрикулярных клапанов уже открыт, обеспечивая приток крови к желудочку, а другой остается на доли секунды закрытым, обеспечивая своеобразную задержку.
Рис. 10. Эхокардиограмма пациента с незначительной сердечной недостаточностью: левый атриовентрикулярный (митральный) клапан открыт, правый атриовентрикулярный (трёх-створчатый) клапан закрыт.
При таком варианте систола и диастола левого желудочка могут начинаться и заканчиваться раньше, чем правого. Это, вероятно, обеспечивает опережение антеградного кровотока по большому кругу кровообращения и отставание венозного возврата к правым отделам сердца, что формирует последовательность, а не синхронность кровотока по легочному и системному кругам кровообращения, а это по причине последовательных изменений градиентов давления может создавать дополнительные условия для облегчения периферической гемоциркуляции.
Таким образом, теория периферического сердца, сформулированная М. В. Яновским, на современном этапе имеет свое экспериментальное и клиническое подтверждение. Разумеется, понимание активных гемодинамических сил на периферии претерпело существенную трансформацию и периферическое сердце представляется как совокупность многокомпонентных факторов, ведущими среди которых, очевидно, являются артериальное и венозное русло, система микроциркуляции, комплекс органов дыхания. Вероятно также, что тканевой и клеточный уровни могут играть существенную роль в формировании и особенностях системной гемоциркуляции.
Литература
- Куршаков Н. А. О периферическом артериальном сердце // Терапевтич. архив. 1923. Т. 1. С. 20.
- Куршаков Н. А., Прессман Л. П. М. В. Яновский: к столетию со дня рождения (1854–1954). М., 1954. 60 с.
- Коновалов Е. Г., Кан Д. Л. ДАН БССР // Цит. по: Аринчин Н. И. Внутримышечное перифери- ческое сердце. Минск, 1974. 150 с.
- Волобуев А. Н., Кошев В. И., Пирогов В. П., Петров Е. С. Некоторые особенности нелинейного моделирования пульсовой волны // Биофизика. 1996. Т. А1. No 2. С. 453–458.
- Волобуев А. Н. Биофизика. М.; Самара, 1999. 168 с. 6. Шпилькина Н. А. Возрастные особенности структурно-функциональных изменений сосудов и миокарда при артериальной гипертензии с метаболическими нарушениями: Автореф. дис. ... канд. мед. наук. СПб., 2003. 22 с.
- Обрезан А. Г., Яровицкая В. Н. Влияние гемодинамических изменений в системе полых вен на внутрисердечную и висцеральную гемодинамику // Стойко Ю. М., Лыткин М. Н., Шайдаков Е. В. Венозная гипертензия в системе полых вен. СПб., 2002. 276 с.
- Шевченко Ю. Л., Бобров Л. Л., Обрезан А. Г. Диастолическая функция левого желудочка сердца. М., 2002. 240 с.
- Малая Л. Т., Горб Ю. Г., Рачинский И. Д. Хроническая недостаточность кровообращения. Киев: Здоров'я, 1994. 624 с.
- Меерсон Ф. З. Адаптация, дезадаптация и недостаточность сердца. М.: Медицина, 1978. 11. Обрезан А. Г. Особенности периферической гемодинамики при эссенциальной и ренопривной гипертензии // Международные медицинские обзоры. 1993. Т. 1. No 1. С. 38–41.
- Кушаковский М. С. Хроническая застойная сердечная недостаточность: Идиопатические кардиомиопатии. СПб.: Фолиант, 1998. 320 с.
- Иванова В. Д., Пирогов В. П., Кошев В. И. и др. Гемодинамическая функция сосудистого русла в норме и эксперименте // Системная гемодинамика и микроциркуляция. Куйбышев, 1983. С. 3–23.
- Иванова В. Д., Кошев В. И., Пирогов В. Л. и др. Гемодинамическая функция сосудистого русла в норме и эксперименте. Самара, 2002. 10 с.
- 15. Обрезан А. Г., Вологдина И. В. Хроническая сердечная недостаточность. СПб.: Вита Нова, 2002. 320 с
Источник: Обрезан А.Г., Шункевич Т.Н. Теория «периферического сердца» профессора М.В.Яновского: классические и современные представления // Вестн. С.-Петерб. ун-та. – Сер. 11., 2008. – Вып. 3. – С. 10-19.