Термин “метаболический синдром” (далее – МС) впервые появился в медицинской литературе в 1967 г. (K. Jahnke et. al.). [9] Этим термином определялась ассоциация ожирения, нарушения толерантности к глюкозе, гиперинсулинемии как маркера инсулинорезистентности, повышенного уровня свободных жирных кислот и триглицеридов в плазме крови как индикаторов дислипидемии. [18] В дальнейшем M. Hanefeld и W. Leonardt (1981) [18] в обзорной статье по этой теме также стали употреблять термин МС. В процессе изучения данной проблемы разными авторами для описания комплекса эндокринно-метаболических нарушений, включаемых в структуру МС, предлагалось большое количество наименований: синдром инсулинорезистентности (HaffnerS.M., 1993), плюриметаболический синдром (Descovich G.C. et al.,1993), дисметаболический синдром (Groop L., Orho-Melander M., 2001). [9] Постепенно расширялось количество компонентов, составляющих понятие МС. Так, G.M. Reaven в 1996 г. предложил включить в МС абдоминальное ожирение, часто сочетающееся с инсулинорезистентностью, нарушение толерантности к глюкозе, гиперинсулинемию, дислипидемию, ранний атеросклероз, недостаточное снижение уровня артериального давления в ночное время, артериальную гипертензию, ишемическую болезнь сердца (далее – ИБС), микроальбуминурию, нарушение гемостаза, нарушение пуринового обмена, синдром ночного апноэ, стеатоз печени и поликистоз яичников. [27]
Формулировка термина МС и его диагностические критерии неоднократно подвергались уточнению. В 2009 г. пять основных научных организаций: Международная диабетическая федерация (IDF), Национальный институт сердца, легких и крови (NHLBI), Американская ассоциация сердца (AHA), Всемирная федерация сердца (WHF), Международное общество атеросклероза (IAS) и Международная ассоциация по изучению ожирения (IASO) опубликовали промежуточный отчет, в котором было достигнуто единое новое определение МС. [16]
Согласно приведенному документу, МС диагностируется на основании трех из пяти следующих критериев:
- повышенная окружность талии (более 80 см у женщин и более 94 см у мужчин – для людей европеоидной расы);
- повышение уровня триглицеридов более 150 мг/дл (1,7 ммоль/л);
- снижение уровня липопротеидов высокой плотности (ЛПНП): у мужчин – менее 40 мг/дл (1,0 ммоль/л), у женщин – менее 50 мг/дл (1,3 ммоль/л);
- повышенное артериальное давление: систолическое – более 130 мм рт. ст., диастолическое – более 85 мм рт. ст.;
- повышенный уровень глюкозы крови натощак – более 100 мг/дл3.
Исследования метаболического синдрома, их значение для клинической медицины
В настоящее время МС является одной из основных проблем общественного здоровья XXI в. МС диагностируется у 25% взрослого населения мира4, а в США выявляется почти у половины жителей старше 50 лет5. Несмотря на актуальность проблемы изучения МС в России, основные сведения о его эпидемиологии, патогенезе, критериях диагностики получены в результате исследований, проведенных в странах Европейского Союза и США. Заболеваемость, этнические и генетические особенности МС у населения РФ изучены недостаточно. Тем более, учитывая детальную проработку проблемы МС, проведены лишь единичные исследования этого комплекса симптомов в отдельных регионах страны. По результатам первого российского исследования, проведенного на случайной выборке взрослого населения (n = 1800) в г. Чебоксары (Чувашская Республика, Приволжский федеральный округ), ока залось, что 20,6% лиц в возрасте 30–69 лет имеют МС; у женщин он встречается в 2,4 раза чаще; с возрастом число больных увеличивается. [24]
В 2008 г. начато многоцентровое национальное исследование НИКА (Национальное Исследование рисКа сердечно-сосудистых осложнений при метАболическом синдроме). Это исследование позволит получить сведения о распространенности компонентов МС в России, выявить особенности эпидемиологии МС в различных регионах РФ, определить прогностическое значение различных комбинаций и пороговых значений факторов риска, входящих в состав МС, и определить наиболее информативные критерии МС для российской популяции. Предусматривается обследование 100 чел. в каждом регионе в качестве пилотного исследования (всего 3 тыс. – 4 тыс. чел.). Продолжительность исследования составит 10 лет, его завершение планируется в 2018 г. [25]
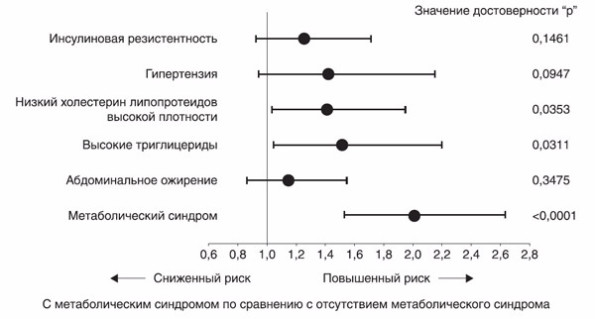
Многочисленные ранее полученные популяционные данные свидетельствуют о том, что у лиц с МС в 2 раза выше риск смерти и в 3 раза больше вероятность возникновения инфаркта миокарда и инсульта по сравнению с лицами, не имеющими МС3. Как показано на рисунке, риск возникновения инфаркта миокарда достоверно выше у пациентов, страдающих МС, чем у больных, имеющих его отдельные компоненты: инсулинорезистентность, артериальную гипертензию, низкий уровень ЛПВП, повышенный уровень триглицеридов и абдоминальное ожирение.
Риск развития инфаркта миокарда при учете единичных факторов риска сердечно-сосудистых заболеваний и под влиянием кумулятивного риска метаболического синдрома
На основании приведенных выше сведений можно заключить, что изучение МС представляется актуальным для врачебной практики и проблема побуждает исследователей к дальнейшему обсуждению и интерпретации вновь
получаемых научных данных.
Некоторые аспекты патогенеза метаболического синдрома
Среди критериев диагностики МС первое место занимает абдоминальное ожирение, которое определяет запуск сложных патофизиологических механизмов. В последних исследованиях1 показано, что клетки жировой ткани – адипоциты – секретируют в кровь биологически активные вещества, называемые цитокинами жировой ткани (адипоцитокинами). К ним относят гепаринсвязывающий эпидермальноподобный фактор роста (ГС-ЭФР), лептин, фактор некроза опухолей (ФНО-а), ингибитор активатора плазминогена 1‑го типа (ИАП‑1), ангиотензиноген. В гепатоцитах эти воспалительные цитокины стимулируют синтез белков острой фазы, таких как С-реактивный белок (СРБ) и фибриноген.
В последние годы в жировой ткани был выявлен ген, кодирующий синтез белка адипонектина. Он является белком плазмы, который ингибирует воспалительные адипоцитокины. Адипонектин постоянно вырабатывается и секретируется нормальными жировыми клетками и содержится в кровотоке в очень высоких концентрациях. При повреждении стенки сосудов адипонектин связывается с субэндотелиально расположенным коллагеном и предотвращает развитие основных атерогенных клеточных реакций: адгезии моноцитов к эндотелиальным клеткам, пролиферации гладкомышечных клеток, образования пенистых клеток, а также разрыва атеросклеротических бляшек [12] Показано, что снижение концентрации адипонектина в плазме крови коррелировало с чувствительностью тканей к инсулину, что позволяет предполагать его связь с развитием инсулино-резистентности.
В исследованиях, проведенных в Италии и Японии, приведены данные, что высокие уровни адипонектина в плазме крови сопровождались более низким риском смерти от сердечно-сосудистых заболеваний, чем в группах с его низкими концентрациями, а при снижении уровня адипонектина в плазме ниже 4 мкг/мл увеличивался риск развития ИБС3. Matsuzawa Y. et. al. (2004) было показано, что при гипоадипонектинемии развивается дисфункция эндотелия, которая может быть одной из причин развития артериальной гипертензии. [13]
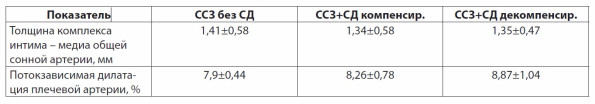
Концентрация адипоцитокинов возрастает с накоплением жира во внутренних органах и влияет на сосудистое русло всего организма. Этот постулат косвенно подтверждается проведенными инструментальными исследованиями (табл. 1): при сердечно-сосудистых заболеваниях без сахарного диабета (ССЗ без СД), сердечно-сосудистых заболеваниях с сахарным диабетом компенсированным (ССЗ + СД компенсир.) и сердечно-сосудистых заболеваниях с сахарным диабетом декомпенсированным (ССЗ+СД декомпенсир.) ультразвуковыми исследованиями (Обрезан А.Г., Бицадзе Р.М., 2009) [19] диагностировалось патологическое утолщение комплекса интима – медиа общей сонной артерии (в качестве нормы экспертами Европейского общества по артериальной гипертензии и Европейского общества кардиологов в 2007 г. выбраны значения толщины стенки менее 0,9 мм) [5] и равнозначное снижение потокзависимой дилатации плечевой артерии в группе пациентов с сердечно-сосудистыми заболеваниями и декомпенсированным сахарным диабетом.
Таблица 1
Показатели толщины комплекса интима – медиа общей сонной артерии (КИМ) и потокзависимой дилатации диаметра плечевой артерии у пациентов с сердечно-сосудистыми заболеваниями
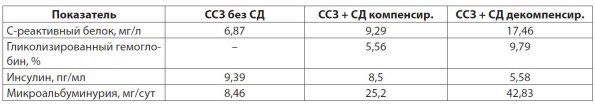
Секретируемые жировой тканью метаболиты воспаления, в частности ФНО-а, связаны с воспалительными реакциями, сопровождающими атеросклероз и сахарный диабет. СРБ, как типичный маркер воспаления, является фактором риска развития атеросклероза и сердечно-сосудистых заболеваний. Установлено, что, кроме синтеза в печени, СРБ может вырабатываться непосредственно в жировой ткани. [13] В исследованиях (Обрезан А.Г., Бицадзе Р.М., 2009) [20] показано, что концентрация СРБ превышает норму (0–5мг/л) во всех трех группах пациентов, а в группе больных, страдающих сердечно-сосудистыми заболеваниями в сочетании с декомпенсированным сахарным диабетом, в 3 раза (табл. 2).
Таблица 2
Показатели С-реактивного белка, гликолизированного гемоглобина, инсулина, микроальбуминурии у пациентов с сердечно-сосудистыми заболеваниями
Учитывая сложное взаимодействие адипонектина с медиаторами воспаления и влияние этого меняющего комплекса факторов на инсулинорезистентность и эндотелий сосудов, можно предположить, что имеется связующее звено между абдоминальным ожирением, ИБС, сахарным диабетом 2‑го типа, т. к. подтверждена реципрокная связь между уровнем адипонектина и факторами риска этих заболеваний. [22]
Таким образом, при МС на сердечно-сосудистую систему воздействует комбинация патогенных факторов, и снизить риск негативных исходов можно только комплексной терапией, направленной на все звенья патологического процесса, включающей немедикаментозное и медикаментозное лечение ожирения, препараты, влияющие на инсулинорезистентность, гиполипедимические и гипотензивные лекарственные средства.
Принципы фармакотерапии сердечно-сосудистых заболеваний у пациентов с метаболическим синдромом: отечественный и зарубежный опыт
При назначении фармакотерапии для лечения сердечно-сосудистых заболеваний у пациентов с МС препаратами выбора будут лекарства, не оказывающие отрицательного влияния на метаболизм, липидный профиль и чувствительность к инсулину.
Лечение сердечно-сосудистых заболеваний как основного звена танатогенеза в комплексной терапии МС отличается от лечения сердечно-сосудистых заболеваний у пациентов без МС.
Комплексная терапия МС предполагает воздействие на его основные компоненты: абдоминальное ожирение, атерогенную дислипидемию, артериальную гипертензию, инсулинорезистентность для достижения главных целей: снижения массы тела, нормализации ночного дыхания, хорошего метаболического контроля, оптимизации уровня артериального давления, предупреждения острых и отдаленных сердечно-сосудистых осложнений. [24]
Для лечения артериальной гипертензии при МС в широкой клинической практике применяются основные группы гипотензивных препаратов: ингибиторы ангиотензинпревращающего фермента (АПФ), антагонисты рецепторов ангиотензина II (АРА), мочегонные препараты, β-адреноблокаторы, α1‑адреноблокаторы, антагонисты кальция, препараты центрального действия (агонисты I1‑имидазолиновых рецепторов) с учетом их влияния на метаболизм и липидный профиль.
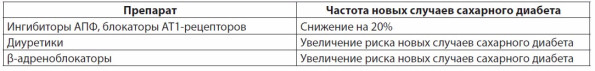
Были проведены клинические исследования для изучения негативного воздействия гипотензивных препаратов на метаболизм и риск развития сахарного диабета. Установлено, что α1‑адреноблокаторы и ингибиторы АПФ несколько улучшают периферическое действие инсулина, в то время как антагонисты кальция и антагонисты рецепторов ангиотензина II остаются метаболически нейтральными в этом отношении. В то же время тиазидные диуретики и неселективные β-адреноблокаторы способны снижать чувствительность к инсулину и ухудшать дислипидемию. [11] Аналогичные результаты получены Opie et. al. (2004) [14] (табл. 3) при мета-анализе 7 многоцентровых крупных рандомизированных исследований (58 100 пациентов) по терапии артериальной гипертензии различными группами антигипертензивных препаратов.
Таблица 3
Влияние гипотензивных препаратов на метаболизм
Ингибиторы АПФ считаются препаратом выбора при лечении артериальной гипертензии, ассоциированной с МС в большинстве стран мира. В то же время в новом руководстве для врачей в Великобритании отмечается, что ингибиторы АПФ и антагонисты кальция не должны широко применяться в качестве препарата первого ряда для лечения гипертонии у миллионов британцев с этим заболеванием. [21]
Проведенные крупномасштабные клинические исследования подтвер-дили высокую безопасность использования иной подгруппы блокаторов ренин – ангиотензин – альдостероновой – системы (РААС) – АРА у больных с МС и сахарным диабетом 2‑го типа, [26] что составляет серьезную дополнительную перспективу для их применения при ассоциациях МС и сахарного диабета с гипертензией.
Антагонисты кальция (АК): дигидропиридиновые (лерканидипин, амлодипин, лацидипин, нимодипин, фелодипин, нифедипин), недигидропиридиновые (верапамил и дилтиазем) по данным большинства клинических и научных наблюдений не влияют на углеводный обмен и инсулинорезистентность. По отдельным литературным источникам лерканидипин обладает высокой селективностью к гладкомышечным клеткам сосудов кролика в эксперименте, что исключает отрицательное инотропное действие5, имеются сведения о его положительном влиянии на метаболизм липидов. В целом антагонисты кальция могут быть рекомендованы для лечения АГ у пациентов с МС, являясь метаболически нейтральными или метаболически полезными
Препараты центрального действия (агонисты I1‑имидазолиновых рецепторов) длительное время позиционируются в качестве метаболически полезных препаратов при ассоциации артериальной гипертензии и МС. В последнее время активно изучалось применение моксонидина для лечения артериальной гипертензии при МС. Абдоминальное ожирение сопровождается нарушением функции эндотелия, повышением тонуса симпатической нервной системы и повышением артериального давления. Моксонидин активирует имидазоловые рецепторы 1‑го типа в среднем мозге, уменьшает центральную симпатическую импульсацию, снижает общее периферическое сопротивление, содержание в крови ренина и ангиотензина II, адреналина и норадреналина в покое и при нагрузке, предсердного натрийуретического фактора (при нагрузке), альдостерона, уменьшает резистентность тканей к инсулину. В исследовании Giussepe D. et. al. (2009) было показано, что монотерапия моксинидином 0,4 мг/сутки у пациентов с умеренной гипертензией и сахарным диабетом 2‑го типа оказала более благоприятное влияние на большинство показателей углеводного обмена и липидный профиль, чем комбинация моксинидина 0,2 мг/сутки и ирбесартана. [3]
Применение мочегонных препаратов (петлевых и тиазидных диуретиков) в качестве гипотензивных средств при МС ограничивается их отрицательным влиянием на углеводный, липидный и пуриновый обмены. В настоящее время препаратом выбора среди мочегонных препаратов является пролонгированная форма индапамида, по фармакологическим свойствам близкого к тиазидным диуретикам. Индапамид ретард не изменяет показатели углеводного обмена у пациентов с артериальной гипертензией и сахарным диабетом, не меняет показатели липидного обмена (содержание в плазме крови триглицеридов, холестерина (ХС), липопротеидов низкой плотности (ЛПНП), ЛПВП). Препарат способствует уменьшению гипертрофии левого желудочка сердца и имеет органопротективное действие. [23, 26]
Назначение β-адреноблокаторов для снижения артериального давления при МС должно иметь обоснованные показания, поскольку β-адреноблокаторы повышают риск развития сахарного диабета до 20% по сравнению с новыми гипотензивными препаратами4. На основании сведений, полученных при проведении многоцентровых исследований, перспективу имеет применение селективного β1‑адреноблокатора с вазодилатирущими свойствами небиволола. Небиволол эффективно снижает артериальное давление у пациентов с МС и сахарным диабетом 2‑го типа; степень снижения артериального давления не зависит от массы тела пациентов, эффективность терапии не снижается у курящих пациентов, не влияет на углеводный обменm(Van Nuetel L c соавт., 1994)5. Необходимо отметить, что наличие сахарного диабета не является противопоказанием для назначения любого типа бета-блокатора, т. е. прогрессирование МС до уровня сахарного диабета, ассоциированного с другими сердечно-сосудистыми заболеваниями, может быть достаточным условием для отсутствия дополнительных ограничений в назначении препаратов этой группы.
Кроме гипотензивной терапии, при МС показано назначение и препаратов иных групп, нацеленных на коррекцию протромботического статуса, атерогенеза, избытка массы тела.
Так, для профилактики ИБС у больных с МС рекомендовано назначение аспирина. АНА рекомендует профилактическое применение аспирина у большинства пациентов с риском возникновения ИБС в течение ближайших 10 лет выше 10% по Фремингемской шкале риска. Следует считать правильным включение в эту категорию больных с МС, если риск ИБС у них выше 10%. Таким образом, для всех больных с высоким риском ИБС необходимо начать или продолжать терапию низкими дозами аспирина. При наличии противопоказаний к аспирину у больных с атеросклеротическими сердечно-сосудистыми заболеваниями необходимо рассмотреть возможность применения клопидогреля. Более того, по отдельным данным, для больных с умеренно высоким риском ИБС также целесообразно рассмотреть возможность профилактического применения низких доз аспирина.
Протромботическое состояние у больных с МС характеризуется увеличением уровней фибриногена, ИТАП‑1 и других медиаторов воспаления, поэтому, кроме коррекции агрегации, препараты ацетилсалициловой кислоты показаны и для профилактики последствий провоспалительного статуса. Действительно, уровень СРБ более 3 мг/л рассматривается как нетрадиционный фактор риска ИБС. Недавно опубликованы совместные рекомендации Американской ассоциации сердца и Центра по контролю и предупреждению заболеваний (Centers for Disease Control and Prevention) по определению СРБ в клинической практике. [4] Согласно этим рекомендациям, определение уровня СРБ должно проводиться по решению врача и ограничиваться пациентами с промежуточным риском ИБС по Фремингемской таблице риска, т. е. от 10 до 20%. Цель определения СРБ у этой категории больных – выделение лиц с его высоким уровнем, у которых категория риска должна быть повышена с промежуточного на высокий. Практические действия после установления высокого риска ИБС – это более агрессивная (интенсивная) модификация образа жизни, назначение небольших доз аспирина и выбор более низких целевых значений ХС ЛПНП.
Гиполипидемическая стратегия при МС отражена в совместном научном заявлении Американской ассоциации сердца и Национального института сердца, легких и крови “Диагностика и лечение метаболического синдрома”. Так, несмотря на первичную патогенетическую значимость в развитии МС триглицеридов, для атерогенной дислипидемии у больных с МС первичной целью курации признан ХС ЛПНП. У таких больных следует снизить уровень ХС ЛПНП до целевых значений, предложенных ATP III (Adult Treatment Panel III (ATP III) – Третья группа экспертов по лечению взрослых Национальной образовательной программы по холестерину США). Вторичной целью для терапии проявлений атерогенной дислипидемии при МС признан не-ЛВП холестерин: если триглицериды превышают 2,3 ммоль/л, следует снизить их до целевых уровней, согласно рекомендациям ATP III. [4] И, наконец, если после достижения целевых значений триглицеридов сохраняется концентрация ХС ЛПВП менее 40 мг/дл (1,0 ммоль/л) у мужчин и менее 50 мг/дл (1,3 ммоль/л) у женщин, следует добиваться повышения ХС ЛПВП в максимально возможной при стандартной терапии атерогенной дислипидемии степени.
Не только выбор сопутствующей терапии, нацеленной на коррекцию артериальной гипертензии, дислипидемии, протромботического или провоспалительного статуса, имеет свои особенности при МС. Осью МС является инсулинорезистентность, имеющая клиническое выражение в виде развернутой картины сахарного диабета, нарушенной толерантности к углеводам или нарушенной гликемии натощак. Современный взгляд на проблему выбора гипогликемизирующих препаратов также учитывает факт ассоциации дисгликемических и гемодинамических нарушений, наличие или отсутствие развернутого МС. Так, препаратами выбора для коррекции гипергликемии в условиях сопутствующих метаболических и гемодинамических расстройств признаны бигуаниды, обладающие сердечно-сосудистым позитивизмом и метаболической полезностью. В то же время “глитазоны” – препараты из группы ”инсулин-сентайзеров”, – несмотря на четкое патогенетическое обоснование их применения при МС, не рекомендованы больным с гемодинамическими нарушениями именно в связи с их негативным влиянием на прогноз при ИБС и недостаточности кровообращения. Секретогены инсулина (препараты сульфонилмочевины), как показано в проспективных наблюдениях, повышают инсулинорезистентность, что также не позволяет считать их препаратами выбора при ассоциированных в рамках МС гликемических и гемодинамических нарушениях. Интересна текущая позиция по отношению к инсулинотерапии при МС. На сегодня считается, что раннее начало инсулинотерапии у больных с МС (за исключением случаев декомпенсации сахарного диабета) представляется нежелательным, т. к., скорее всего, будет усугублять клинические проявления гиперинсулинизма. Однако следует отметить, что, во избежание осложнений сахарного диабета, компенсация углеводного обмена должна быть достигнута любой ценой. При неудовлетворительном эффекте от ранее перечисленных видов лечения должна быть назначена инсулинотерапия, возможно, в допустимых комбинациях с пер оральными сахароснижающими препаратами. В отсутствие противопоказаний предпочтительна комбинация с бигуанидами.
Интересным представляется вопрос о рекомендованной степени гликемического контроля. В январе 2009 г. на сайте журнала Circulation ADA, ACC, Американская ассоциация сердца опубликовали совместный документ на основании результатов исследования VADT и с учетом двух предшествующих работ (ACCORD, ADVANCE). [6] Приведенные исследования обосновали неожиданные результаты: интенсивная сахароснижающая терапия не приводила к желаемому снижению сердечно-сосудистых осложнений. Сегодня это положение активно используется в интенсивной терапии. В амбулаторно-поликлинических и стационарных условиях также принята стратегия менее жесткого контроля гликемии.
В заключение хотелось бы привести современные положения о терапии ожирения при МС. Разумеется, не всякий случай МС предусматривает избыток массы тела, поскольку ключевым критерием диагностики МС считается факт абдоминального ожирения. Тем не менее, ожирение составляет центральное звено патогенеза не только метаболических, но и гемодинамических нарушений, что указывает на ключевую необходимость коррекции избытка массы тела при МС. Несмотря на важную патогенетическую значимость обсуждаемого компонента МС, фармакология средств для терапии ожирения не предлагает адаптированных средств для коррекции индекса массы тела, ассоциированных с метаболическими расстройствами. Более того, большинство препаратов, вмешиваясь преимущественно в серотониновый и норадреналиновый метаболизм, имеют побочные сердечно-сосудистые эффекты в виде повышения артериального давления. Еще более интересными представляются сведения Davenport et al. (2009) [2] о более благоприятных исходах при сердечно-сосудистых катастрофах у лиц с избытком массы тела или с ожирением 1‑й степени по сравнению с таковыми у больных с нормальной массой тела.
Выводы
На основании приведенных данных можно заключить, что при лечении сердечно-сосудистых заболеваний у пациентов с МС фармакотерапия должна назначаться с учетом влияния применяемых лекарственных препаратов на метаболизм глюкозы и липидный профиль. С другой стороны, коррекция дисгликемии и иных метаболических расстройств требует учета многочисленных сердечно-сосудистых эффектов. Таким образом, проблемы курации сердечно-сосудистых и дисметаболических изменений при МС представляются комплексными, интересными и требующими дальнейших исследований и дискуссий.
Литература
- Angelico P, Guarneri L, Leonardi A et al. Vascular-selective effect of lercanidipine and other 1,4-dihydropyridines in isolated rabbit tissues. J Pharm Pharmacol 1999; 51. P.709–714.
- Davenport, D.L., et al. The influence of body mass index obesity status on vascular surgery 30-day morbidity and mortality. Journal of Vascular Surgery. 2009. 49:140–147. [MEK]
- Giuseppe Derosa, Arrigo F.G. Cicero, et.al. Метаболические и антигипертензивные эффекты моксонидина и комбинации моксонидина с ирбесартаном у пациентов с сахарным диабетом 2 типа и умеренной гипертензией: последовательное, рандимизированное, двойное слепое клиническое исследование. Международный медицинский бюллетень. Обзоры клинической кардиологии. 2009. № 20. С. 28–32.
- Grundy SM, Cleeman JI, Daniels SR, et. al., Diagnosis and management of the metabolic syndrome. An American Heart Association/National Heart, Lung, and Blood Institute Scientific Statement. Executive Summary. Circulation. 2005. 112: P. 285–290.
- Guidelines for the management of arterial hypertension // Eur. Heart Journal. 2008. № 28. Р. 1462–1536.
- Intensive Blood Glucose Control and Vascular Outcomes in Patients with Type 2 Diabetes The ADVANCE Collaborative Group N Engl J Med 2008; 358: 2560–2572. June 12, 2008.
- International Diabetes Federation IDF-Worldwide Definition of the Metabolic Syndrome. www.idf.org/metabolic_syndrome.
- International Diabetes Federation, 1967/ Ostmann J. (ed). Experta Medica, 1969. P. 533-539.
- JankeK., Daweke H., Liebermeister H. et.al. Hormonal and metabolic aspects of obesity in humans // Proceedings of sixth congress of the
- Joint Scientific Statement. Harmonizing the Metabolic Syndrome. Circulation 2009; 120:1640–1645. American Heart Association, Inc – www.circ.ahajournls.org/cgi/content/full/120/16/40.
- Keulen L., Henricsen E. J, Jacobs S., et. al. Антигипертензивная терапия и управление сердечно – сосудистым риском у больных метаболическим синдромом: фокус на симпатическую нервную систему и резистентность к инсулину. Международный медицинский бюллетень “Обзоры клинической кардиологии”. 2006. № 8. www.cardiosite.ru/articles/article.aspx?articled=4438&rubricid =93.
- Matsuzawa Y. Цитокины жировой ткани и появление обменных факторов риска: новые данные. Метаболический синдром в повседневной врачебной практике. MetS insights, SOLVAY Pharmaceuticals. 2007. № 12. С. 4–9.
- Matsuzawa Y., FunahashiT., Kihara S. Adiponectin and metabolic syndrome. Arterioloscler Thromb Vasc Biol 2004. С. 24, 29–33.
- Opie L.H., Schal R. Old antihypertensives and new diabetes // J. Hypertens. 2004. Vol . 22. P. 1453–1458.
- The Merck Manual. Руководство по медицине. Диагностика и лечение / Гл. ред. Марк Х. Бирс; пер. с англ. под ред. А.Г. Чучалина. 2-е изд. М.:Литтерра. 2011. С. 77.
- The Metabolic Syndrome Institute – www.metabolicsyndromeinstitute.com.
- Van Nueten L., et al. Overview of therapeutic efficacy and safety of Nebivolol in the treatment of hypertension. Clin Res Report on R67555. 1994.
- Беляков Н.А., Сеидова Г.Б., Чубриева С.Ю. и др. Метаболический синдром у женщин (патофизиология и клиника). СПб: Издательский дом
- Бицадзе Р. М, Дорофейков В.В., Обрезан А.Г. Клинические особенности сердечно-сосудистых заболеваний, кардиальная автономная нейропатия и дисфункция эндотелия при сахарном диабете 2 типа. // Вестник Санкт-Петербургского университета. Серия 11 “Медицина”. Выпуск 1 (январь 2009 г.). СПб.. С. 57–63.
- Бицадзе Р.М, Дорофейков В.В., Обрезан А.Г. Метаболические особенности сердечно-сосудистой патологии у больных сахарным диабетом 2 типа // Вестник Санкт-Петербургского университета. Серия 11 “Медицина”. СПб. Выпуск 1 (июнь 2009 г.). С. 3–10.
- Дженни Хоуп. Бета-блокаторы повышают риск развития сахарного диабета. Международный медицинский бюллетень. Обзоры клинической кардиологии. 2009. № 17. С. 18. кардиологии”. 2006. № 8 – www.cardiosite.ru/articles/article.aspx?articled=4435.
- Метаболические нарушения в патогенезе атеросклероза и методы их коррекции: Методическое пособие / Сост. Н.В. Перова, В.А. Метельская. М.: ГОУ ВПО “Московский государственный медико-стоматологический университет”. 2008. С. 29.
- Мычка В.Б., Чазова И.Е. Метаболический синдром: современные подходы к лечению. Consilium medicum. // Журнал доказательной медицины для практикующих врачей. 2006. № 9. Т. 8 – www.old.consilium medicum. com/media/consilium/06_09/66.shtml.
- Национальные клинические рекомендации. Диагностика и лечение метаболического синдрома // Кардиоваскулярная терапия и профилактика. 2007. № 6 (6) Приложение 2. С. 254–255.
- Общероссийская общественная организация “Содействия профилактике и лечению артериальной гипертензии “АНТИГИПЕРТЕНЗИВНАЯ ЛИГА”. Деятельность Лиги. Научная деятельность. www.ahleague.ru/index.
- Подзолков В.И., Гладышева Е.А. Панферов А.С. Метаболический синдром: современные возможности лечения // Обзоры клинической кардиологии. 2006. № 8 – www.cardiosite.ru/articles/article.aspx?articled=4435. СПбМАПО, 2005. С. 10.
- Шилов А.М., Авлашумов А.С. , Галанова А.С. и др. Ожирение и артериальная гипертония // Международный медицинский бюллетень. Обзоры клинической кардиологии. 2009. № 17. С.12.
Источник: Обрезан А.Г., Загородский А.Н. Современные принципы лечения сердечно-сосудистой патологии при метаболи-ческом синдроме \\ Заместитель главного врача. – 2012. - №1 (68). – С. 96-107.