После первого клинического применения английским врачом W.Whithering в 1785 г., препараты дигиталиса на протяжении более 200 лет занимали ведущее место в лечении хро-нической сердечной недостаточности (ХСН). Правда, в конце XX века, появились сомнения в их эффективности и безопасности. Многочисленные исследования указывали на преимущественное действие гликозидов на качество жизни, кратковременное улучшение клинического статуса пациентов, неблагоприятные гуморальные сдвиги, истощение миокардиальных энер-гетических резервов. Пришлось вновь доказывать истину о пользе сердечных гликозидов при хронической сердечной недостаточности. В исследованиях PROVED и RADIANCE отмена дигоксина привела к ухудшению клинического состояния больных, которое до этого было стабилизировано на фоне сочетания дигоксина с мочегонными препаратами или ингибиторами АПФ. Позже, в исследовании DIG, был снят главный вопрос всех дискуссий - о безопас-ности лечения сердечными гликозидами. Оказалось, что у пациентов с сердечной недостаточностью и сохраненным синусовым ритмом дигоксин значительно улучшал состояние и не влиял на показатели общей смертности. Целесообразность же лечения дигоксином больных с ХСН и мерцательной аритмией под сомнение не ставилась никогда.
Терапевтическое действие сердечных гликозидов (СГ) обусловлено, прежде всего, положительным инотропным эффектом (повышение силы и скорости сокращения миокарда), что определяет основное показание к их использованию – несостоятельность сократительной функции миокарда. Сердечное сокращение делается более коротким и экономичным в энер-гетическом отношении. Этот же эффект ограничивает использование СГ при митральном стенозе.
Отрицательный хронотропный эффект (снижение функции автоматизма синусового узла), больше выраженный у неполярных СГ, ведет к полноценной диастоле, улучшению энергетического и электролитного обмена в миокарде, но этот эффект сдерживает применение СГ при выраженной брадикардии и при недостаточности клапанов аорты (увеличение перегрузки сердца объемом).
Отрицательный дромотропный эффект (увеличение эффективного рефрактерного пе-риода АВ соединения) позволяет купировать или урежать наджелудочковые тахикардии и тахиаритмии (исчезновение дефицита пульса). Напротив, при синдроме WPW СГ противопо-казаны, так как, замедляя АВ-проводимость, они провоцируют развитие пароксизмальной та-хикардии.
Положительный батмотропный эффект (повышение возбудимости миокарда) проявляется только в субтоксических дозах или при гипокалиемии и гиперкальциемии.
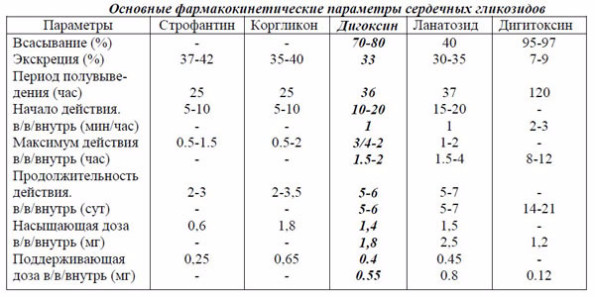
Применяемые в настоящее время СГ классифицируются по своим физико-химическим свойствам, в значительной мере определяющим особенности их фармакотерапевтического действия и фармакокинетики. Гликозиды подразделяются на: полярные (гидрофильные) - Строфантин, Коргликон; неполярные (липофильные) - Дигитоксин; относительно полярные – Дигоксин, Ланатозид-С. Биодоступность неполярного препарата - дигитоксина - 90-100%, относительно полярного дигоксина - 50-80%, ланатозида - 15-45%, а полярных –строфантина и коргликон - не более 5%. Биодоступность пероральных СГ зависит от кислотности желудочного сока (при гиперацидных состояниях большая часть их разрушается) и моторики кишечника.
Полярные СГ практически не проникают в соединительную ткань, что снижает объем их распределения и обуславливает более высокую их концентрацию в крови у лиц пожилого возраста и с ожирением. Они практически полностью выводятся с мочой, поэтому при нарушенной функции почек предпочтительно назначение дигитоксина. Неполярные СГ абсорбируются в кишечнике и метаболизируются преимущественно в печени, поэтому при гепатитах, циррозах, почечно-печеночном блоке препаратом выбора являются полярные гликозиды.
У больных ХСН, вызванной систолической дисфункцией левого желудочка, преобладают опосредованные вазодилатирующие влияния СГ на артериолы и вены, поэтому внутривенное их введение вызывает уменьшение периферического сопротивления сосудов (посленагрузки) и давления в легочных капиллярах (преднагрузки), что сопровождается существенным увеличением сердечного выброса, несмотря на уменьшение ЧСС.
Благоприятный клинический эффект СГ при длительном применении у больных ХСН связан также со способностью подавлять повышенную активность симпато-адреналовой и ренин-ангиотензин-альдостероновой систем. В терапевтических дозах СГ повышают активность парасимпатической вегетативной нервной системы и снижают активность симпатической. В токсических дозах повышают активность симпатической нервной системы, что проявляется усиленным высвобождением норадреналина.
Дигоксин (ланикор, ланоксин, диголан, цедоксин) получают из листьев наперстянки шерстистой. Установлена линейная зависимость между клиренсами препарата и креатинина, поэтому при почечной недостаточности (скорость клубочковой фильтрации ниже 50 мл/мин) дозу дигоксина необходимо уменьшить. С целью получения терапевтического эффекта достаточно назначить препарат по 0,25-0,5 мг/сут в течение 7-10 дней. Обычные поддерживаю-щие дозы дигоксина для приема внутрь составляют от 0,125 до 0,5 мг/сут.
Ланатозид-С (изоланид, целанид, цедиланид) получают из листьев наперстянки шерстистой. В связи с худшей всасываемостью ланатозида его насыщающая и поддерживающая дозы при приеме внутрь примерно в 2 раза выше, чем дигоксина.
Строфантин представляет собой гликозиды из семян строфанта Комбе. Он в мень-шей степени, чем другие СГ, влияет на ЧСС и АВ-проводимость, и меньше кумулируется в организме.
Дигитоксин (кардитоксин, кардигин) получают из листьев наперстянки пурпуровой. После в/в введения других СГ для перевода на пероральный прием в течение 2 дней назначают удвоенную дозу дигитоксина (0,1-0,3 мг/сут), затем переходят на обычные поддерживающие дозы (0,12 мг). Напротив, после длительной пероральной терапии дигитоксином необходимо делать двухдневный перерыв, прежде чем перейти на поддерживающие дозы дигоксина.
Коргликон содержит сумму гликозидов из листьев ландыша. По характеру действия близок к строфантину.
Следующие факторы повышают чувствительность к СГ: пожилой возраст; уменьшение размеров функционирующего миокарда (ишемия и острый инфаркт миокарда, миокардит, кардиомегалия); электролитные расстройства (гипокалиемия, гипомагниеми, гиперкальциемия); легочная; почечная (для дигоксина и ланатозида) и тяжелая печеночная недостаточность (для дигитоксина); гипотиреоз; совместное применение препаратов (диуретики, симпа-томиметические амины, бета-адреноблокаторы, эуфиллин, хинидин, октадин, амиодарон, пропафенон, верапамил, дилтиазем, нифедипин, клонидин, диазепам, индометацин, ибупрофен, анаболические стероиды, витамины В1, В2, В6, метилурацил, АТФ, тетрациклин, эритромицин, циклоспорин).
Факторы, снижающие чувствительность к СГ включают: гипертиреоз; совместное применение препаратов (антациды, холестирамин, фенобарбитал, дифенин, гидралазин, активированный уголь, отруби, блеомицин, винкристин, доксорубицин, циклофосфан, цитарабин, неомицин, рифампицин, сульфасалазин) лучевая терапия.
В связи с многообразием и изменчивостью факторов, определяющих чувствительность к СГ, для длительного приема целесообразно использование внутрь малых доз препаратов - не более 0,25 мг/сут дигоксина или эквивалентные дозы других средств. При этом полностью проявляется их экстракардиальное нейромодуляторное действие (снижается активность симпатоадреналовой и ренин-ангиотензин-альдостероновой систем и увеличивается плотность бета-2-адренорецепторов лимфоцитов) и не выражено инотропное и противо-аритмическое влияние, что позволяет значительно снизить частоту токсических побочных эффектов у больных ХСН. Это тем более оправдано, так как зависимость положительного инотропного эффекта СГ от дозы препарата не является линейной - 2/3 кардиотонического эффекта полной дозы препарата достигается при назначении его половинной дозы.
Абсолютными противопоказаниями к назначению СГ являются: гликозидная интоксикация (или подозрение на нее) и атриовентрикулярная блокада I-III ст. Относительные противопоказания - желудочковые аритмии; синдром слабости синусового узла; выраженная синусовая брадикардия (ЧСС< 50); мерцательная аритмия с редким ритмом желудочков; АВ-блокада I ст.; синдром WPW (риск ускорения антеградного проведения по дополнительному пучку с развитием желудочковой тахикардии или фибрилляции желудочков); гипертоническое сердце при фракции выброса > 40%; постинфарктный период при отсутствии фибрилляции предсердий (фракция выброса >35%); гипокалиемия; гиперкальциемия; почечная недостаточность; легочно-сердечная недостаточность III ст. При терапевтических концентрациях дигоксина в крови электроимпульсная терапия не увеличивает риска возникновения аритмий по сравнению с больными, не получающими СГ. Лишь при гликозидной интоксикации электроимпульсная терапия предрасполагает к развитию желудочковой тахикардии.
Оценка эффективности дигиталисной терапии
Показателями оптимального насыщения гликозидами является субъективное улучшение состояния, уменьшение размеров застойной печени и отеков, увеличение диуреза. Снижение ЧСС до 60-70 уд/мин не является надежным критерием эффективности дигиталисной терапии ни при мерцательной аритмии, ни у больных с синусовым ритмом, так как влияние СГ на синусовый и АВ- узлы зависит, в основном, от соотношения между симпатической и парасимпатической активностью и не коррелирует с их инотропным действием.
Одной из задач лечения ХСН является повышение толерантности к физической нагрузке, поэтому оценивать эффективность СГ следует по величине ЧСС в условиях покоя, а также по выраженности клинических проявлений ХСН на высоте умеренной дозированной физической нагрузки (при ЧСС не более 120 в мин).
Несмотря на двухвековой опыт клинического использования сердечных гликозидов для лечения ХСН, не существует общепринятых критериев оценки их клинической и гемодинамической эффективности. Изменения ЭКГ в виде удлинения PQ, уменьшение амплитуды зубца T, снижение сегмента ST, укорочение интервала QT и особенно появление типичной «корытообразной» формы конечной части желудочкового комплекса считаются признаками остаточного насыщения сердечных гликозидов. Характерная корытообразная депрессия сегмента ST лучше всего регистрируется в отведениях ЭКГ с высоким зубцом R. При исходно неизмененной до лечения гликозидами кардиограмме вышеперечисленные изменения конечной части желудочкового комплекса ЭКГ лучше всего выявляются обычно в левых грудных, а также в отведениях от задней стенки левого желудочка. Но надо сказать, что удовлетвори-тельный терапевтический эффект может быть получен в результате длительного применения небольших доз СГ и при отсутствии этих признаков. «Гликозидные» изменения ЭКГ трудно распознать у больных с гипертрофией левого желудочка или с блокадой левой ножки пучка Гиса. Вместе с тем характерная вогнутость сниженного сегмента ST может указывать на то, что пациент принимает сердечные гликозиды. Нормализация интервала QT у больных с гипертрофией левого желудочка или с блокадой левой ножки пучка Гиса также может свиде-тельствовать о приеме препаратов наперстянки, так как при этой патологии интервал QT обычно удлинен.
Принципы применения СГ
Лечение СГ состоит из 2 этапов: введение препарата в количестве, достаточном для получения гемодинамического и клинического эффекта (дигитализация) и проведение поддерживающей терапии.
Выделяют быструю, умеренно быструю и медленную дигитализацию.
Быстрая дигитализация часто приводит к гликозидной интоксикации (в 40-50% случаев), а необходимость в ней возникает крайне редко.
Умеренно быстрая дигитализация осуществляется путем введения в течение трех суток – два дня по 50% насыщающей дозы, на третий день - оставшейся части (с учетом экс-креции гликозида). Эта методика используется для лечения больных с тяжелой ХСН. Примером ее является назначение внутрь дигоксина, средняя насыщающая доза которого составляет 1,8 мг (см. фармакокинетические параметры СГ).
В 1-й день назначают 1 мг (дважды по 0,5 мг) дигоксина, что составляет чуть больше 50% средней насыщающей дозы. С учетом суточной экскреции 0,33 мг препарата (33%) ко 2-м суткам в организме остается 0,67 мг дигоксина (введенная доза минус суточная экскреция).
На 2-й день вновь назначают 1 мг препарата. Экскреция за 2-е сутки составляет 0,56 мг (33% от 1.67 мг). К началу 3-го дня в организме остается 1,11 мг (1,67–0,56) дигоксина.
На 3-й день больному дают 0,75 мг препарата. Суммарная доза при этом составляет 1,86 мг (1,11+0,75), что практически соответствует средней насыщающей дозе. В дальнейшем для поддержания насыщающей дозы необходимо назначать поддерживающую дозу равную суточной экскреции – 0,6 мг (33% от 1,86 мг) дигоксина.
Дигитализация медленным темпом, наиболее распространенная, удобная и наименее опасная в плане развития аритмий. Больной получает ежедневно постоянную (фиксирован-ную) дозу сердечных гликозидов и через 5 периодов полувыведения (Т½) суточная экскреция вводимого препарата становится равной ежедневно вводимой фиксированной дозе, которая автоматически становится поддерживающей. При этом содержание сердечных гликозидов в крови стбилизируется при выбранной ежедневной фиксированной дозе. Если через 5 Т½ ожидаемый эффект не возникает, дальнейшее применение препарата в прежней дозе бессмысленно и его суточную дозу нужно увеличить. После ее увеличения максимальный клинический эффект достигается также через 5 Т½. При этом наибольший риск гликозидной ин-токсикации будет наблюдаться в течение 5 Т½ выбранного препарата.
Сложность поддерживающего лечения СГ состоит в том, что фиксированная поддерживающая доза не может быть постоянной из-за меняющегося функционального состояния пациента и изменений его чувствительности к препарату. Кроме того, чувствительность больных к СГ зависит от сочетания их с другими лекарствами.
Смена способа введения сердечных гликозидов
Наибольшие трудности возникают при назначении внутривенно вводимых строфантина и коргликона в случае обострения ХСН на фоне предшествующего перорального лечения СГ (опасность дигиталисной передозировки). Перед сменой способа введения следует сделать перерыв в терапии СГ, длительность которого зависит от свойств и дозы препарата, принимаемого внутрь. Первые дозы строфантина или коргликона должны быть минималь-ными и вводиться под контролем ЭКГ.
При переходе от гликозида, вводившегося внутривенно, к препарату, принимаемому больным внутрь, необходимо действовать по следующему алгоритму:
- определить, какой процент от средней поддерживающей дозы составляет индивидуальная поддерживающая доза внутривенно вводимого препарата;
- определить индивидуальную поддерживающую дозу выбранного СГ для приема внутрь (она должна составлять ту же часть средней поддерживающей дозы, что и доза, вводимая внутривенно);
- назначить пероральный препарат на следующий день после отмены внутривенного введе-ния гликозидов.
Например, оптимальный терапевтический эффект у больного достигнут при использовании строфантина в дозе 0,125 мг (0,25 мл 0,05% раствора), что составляет 50% от средней поддерживающей дозы. Для поддерживающего лечения выбран целанид в дозе 0,4 мг, (его средняя поддерживающая доза - 0,8 мг). Целанид следует принять на следующий день после отмены строфантина.
Изложенный способ прост и позволяет практически полностью устранить риск развития гликозидной интоксикации. Однако при подобной тактике со 2 по 6 день лечения дигоксином и целанидом и со 2 по 14 день приема дигитоксина будет отмечаться некоторое уменьшение суммарного содержания СГ в крови и, возможно, ухудшение клинического состояния больного, но эти явления преходящи и редко вызывают стойкое нарастание ХСН.
Гликозидная интоксикация наблюдается у 5-15% стационарных больных, получающих СГ. Характерные для терапии сердечными гликозидами изменения ЭКГ (удлинение PQ и корытообразная форма конечной части QRS) нельзя безоговорочно отнести ни к терапевтическим, ни к токсическим эффектам. По современным представлениям, эти изменения следует считать признаками чрезмерной и иногда опасной дигитализации, например, у больных, недавно перенесших острый инфаркт миокарда.
Типичными для гликозидной интоксикации считаются желудочковые экстрасистолы по типу би- или тригеминии, политопная (полиморфная) желудочковая экстрасистолия, непароксизмальная тахикардия из АВ-узла, АВ-блокада любой степени. Вообще, в результате интоксикации сердечными гликозидами могут возникнуть практически любые нарушения ритма (редко - трепетание предсердий и блокады ножек пучка Гиса). Причем у одного и того же больного на протяжении короткого периода времени могут возникать разные нарушения ритма и проводимости сердца. Следует помнить, что если на ЭКГ одновременно отмечаются признаки усиления автоматизма и нарушения проводимости, то в первую очередь необходимо заподозрить интоксикацию сердечными гликозидами. Отметим, однако, что интоксикация сердечными гликозидами – это клинический диагноз и по одним лишь данным ЭКГ его не верифицируют.
Почти у половины больных экстракардиальные признаки служат единственным проявлением гликозидной интоксикации. Это желудочно-кишечные (анорексия, тошнота, рвота, понос, боли в животе, нарушения всасывания) и неврологические (головная боль, слабость, расстройства зрения, бессоница, судороги, спутанность сознания, заторможенность, потеря ориентации, делирий) расстройства.
Лечение дигиталисной интоксикации требует, прежде всего, отмены СГ. Далее следует назначить 50-100 г активированного угля или 4-8 г холестирамина, определить содержание электролитов (калия, натрия, кальция) в крови, проводить непрерывное мониторирование ЭКГ. Препаратами выбора для лечения гликозидной интоксикации являются фенитоин и лидокаин. При назначении препаратов калия необходимо соблюдать осторожность. Внутривенное их введение показано больным с подозрением на гликозидную интоксикацию, при падении уровня калия в крови ниже 4 мэкв/л, а при наличии АВ-блокады II степени - лишь больным с уровнем калия ниже 3 мэкв/л. При брадиаритмиях назначают атропин, а в случае его неэффективности прибегают к временной электрической стимуляции сердца.
Специфическим антидотом являются Fab-фрагменты специфических антител к дигоксину, получаемых путем иммунизации баранов (препараты «Дигибид» или «Дигиталис-Антидот ВМ»). Они способны связываться с дигоксином и дигитоксином с образованием иммунного комплекса, выводимого почками.
Место сердечных гликозидов в лечении ХСН
С появлением петлевых диуретиков, периферических вазодилататоров и негликозидных инотропных средств, пригодных для внутривенного введения, показания к внутривенному введению СГ для купирования сердечной астмы и отека легких значительно сузились. Единственным патогенетически обоснованным показанием для этого остаются наджелудочковые тахиаритмии. При этом препаратом выбора является дигоксин, в меньшей степени ла-натозид.
Из-за высокого риска развития опасных для жизни аритмогенных побочных эффектов внутривенное введение СГ противопоказано в остром периоде инфаркта миокарда и при хроническом легочном сердце.
При решении вопроса о целесообразности назначения СГ внутрь важно учитывать не столько выраженность клинических проявлений ХСН, сколько основной механизм ее развития у данного больного. В качестве кардиотонических средств СГ не следует назначать больным с ХСН, обусловленной диастолической дисфункцией левого желудочка, и при состояниях с высоким сердечным выбросом (тиреотоксикоз, анемия, ожирение, цирроз печени). Спорным остается вопрос о целесообразности длительной терапии гликозидами больных с ХСН при системной и легочной АГ, аортальном стенозе (клапанном, надклапанном и подклапанном), аортальной или митральной регургитаци, дефекте межжелудочковой перегородки, от крытом артериальном протоке, хроническом легочном сердце при отсутствии мерцательной аритмии.
По современным представлениям, патогенетически обоснованным можно считать назначение СГ внутрь больным с умеренной или тяжелой ХСН, вызванной систолической дисфункцией левого желудочка (постинфарктный кардиосклероз, дилятационная кардиомиопатия, миокардит).
Общепризнано, что СГ особенно эффективны у больных с ХСН II-IV ФК по NYHA в сочетании с мерцательной аритмией. В этом случае они увеличивают сократимость миокарда левого желудочка и улучшают его наполнение за счет замедления сердечного ритма и увеличения продолжительности диастолы.
При стабильном течении ХСН многие больные с синусовым ритмом могут обходиться без приема СГ внутрь, если они получают адекватную терапию диуретиками и периферическими вазодилататорами (как правило, это комбинация тиазидового диуретика и ингибитора АПФ или добавление к этой схеме изосорбида динитрата или гидралазина).
Целесообразно назначать гликозиды больным с синусовым ритмом при ХСН III-IY ФК, фракцией выброса левого желудочка меньше 35% и при наличии ритма галопа, когда не удается достигнуть стабилизации состояния с помощью комбинации диуретика и ИАПФ.
Алгоритм выбора медикаментозной терапии у больного с ХСН при синусовом ритме можно представить следующим образом. (Каждое последующее назначение предусматривает неэффективность предыдущего.)
При ХСН с преимущественно нарушенной систолической функции миокарда.
1. При ХСН I и II функциональных классов:
- ингибиторы АПФ
- диуретики
- сочетание ингибиторов АПФ с диуретиками
Дополнительно:
- а) при АГ – альфа-адреноблокаторы (празозин, доксазозин)
- б) при ИБС - нитраты
При стойком сохранении симптомов ХСН или при плохой переносимости ингибиторов АПФ:
- а) сочетание изосорбида динитрата с гидралазином и диуретиками
- б) сердечные гликозиды
2. При ХСН III и IV функциональных классов:
- сочетание диуретиков с ингибиторами АПФ и СГ
- сочетание диуретиков с ингибиторами АПФ и СГ + нитраты
- сочетание диуретиков с ингибиторами АПФ и СГ + нитраты+ гидралазин
- сочетание диуретиков с ингибиторами АПФ и СГ + нитраты + бета-адреноблокаторы в малых дозах
3. При выраженной артериальной гипотензии
- диуретики и СГ
- малые дозы ингибиторов АПФ (после повышения АД)
4. При выраженной почечной недостаточности с нормальным или повышенным АД
- гидралазин с нитросорбидом и диуретиками
- петлевые диуретики
5. При дилатационной кардиомиопатии
- вазодилататоры (нитраты, нитропруссид натрия) при контроле за ОЦК и со-держаниемм натрия
- ингибиторы АПФ
- бета-адреноблокаторы (преимущественно при тахикардии на фоне идиопатиче-ской кардиомиопатии)
- сердечные гликозиды (преимущественно при тахисистолической форме мерцательной аритмии)
При преимущественно нарушенной диастолической функции миокарда
1. При ХСН I и II функциональных классов:
- Диуретики
СГ не показаны.
2. При ХСН III и IV функциональных классов:
- диуретики
- ингибиторы АПФ
- блокаторы кальциевых каналов
- бета-адреноблокаторы в малых дозах
- нитраты
СГ не показаны, если нет фибрилляции предсердий или наджелудочковой тахикардии.
3. При гипертрофической кардиомиопатии - бета-адреноблокаторы (при противопоказаниях к их применению - верапамил или дилтиазем)
В заключение, целесообразно подчеркнуть, что согласно современным рекомендациям по лечению сердечной недостаточности (ACC/AHA, 2001) сердечные гликозиды целесообразно назначать больным с ХСН стадии С (пациенты с морфологичесими изменениями сердца, сочетающимися с клиническими и инструментальными проявлениями левожелудочковой недостаточности) и стадии D (рефрактерная, конечная стадия ХСН с выраженными необратимыми морфологическими изменениями и частично-обратимыми функциональными изменениями). При этом, в соответствии с современными представлениями доказательной медицины рекомендации по назначению СГ соответствуют I классу и уровню очевидности «А», что свидетельствует о научной и практической обоснованности их применения, доказанной в нескольких многоцентровых, плацебо-контролируемых исследованиях. Согласно приводимым в цитируемом документе данным, СГ не только улучшают качество жизни и клинические симптомы у больных с ХСН, но и существенно снижают комбинированный риск смертности и частоты госпитализаций. В тактическом отношении рациональны комбинации СГ с ингибиторами АПФ и бета-адреноблокаторми. Несмторя на то, что многие СГ используются в повседневной практике, лишь дигоксин является наиболее широкоприменяемым в США препаратом и единственным гликозидом, оцененным в плацебо-контролируемых исследованиях.
Литература:
- Бобров Л.Л., Гайворонская В.В., Куликов А.Н., Обрезан А.Г., Филиппов А.Е., Щербак Ю.А. Клиническая фармакология и фармакотерапия внутренних болезней (учебно-методическое пособие) С.Пб.: ВМедА.- 2000 - 365 c.
- The Merck Manual of diagnosis and therapy (seventeenth edition) // Ed. by M.H. Beers and R. Berkow. – USA, Phyladelphia, Pensilvania: National Publishing Company. – 1999. – 2833 p.
- Braunwald E. Heart disease: a textbook of cardiovascular medicine / Ed. E.Braunwald. – 4th ed. - Philadelphia.: Sounders. – 1992. - 1874, Xl.IV p.
- ACC/AHA Guidelines for the Evaluation and Management of Chronic Heart Failure in the Adult // Journal of the American College of Cardiology. 2001. – December, N11.
Источник: Обрезан А.Г., Свистов А.С., Щербак Ю.А., Николин К.М.. Практические основы применения сердечных глико-зидов при хронической сердечной недостаточности (Часть 1) // Terra Medica. - 2002. - № 2 (26). - C. 3-6.