В статье представлены результаты диагностики и лечения 30 мужчин в возрасте 30-45 лет(средний возраст 36,2±5,3 года ) с ХАП и мужским фактором бесплодия в браке. Из них 15 больных с ХАП и секреторным типом бесплодия (1-я группа) средний возраст 35,2±4,3 года, 15 мужчин с бесплодием, обусловленным ХАП и варикоцеле в послеоперационном периоде (2-я группа) (средний возраст 33,6±3,3 года). Давность мужского фактора бесплодия колебались от 1 до 4,5 лет и в среднем достигали 2,8±1,6 лет. После тщательного анкетирования и обследования включая спермограмму, определение антиспермальных антител (АСАТ), тест на фрагментацию ДНК, электронное микроскопическое исследование эякулята(ЭМИС) больные первой группы получали Простатилен-АЦ в виде суппозиторий ректальных в течении 10 дней. Пациенты второй группы получали Простатилен-АЦ в виде суппозиторий ректальных в течении 20 дней. Доказано улучшение качество жизни и показателей сперматогенеза с снижением MAR-теста более выраженное в второй группе, индекса фрагментации ДНК и улучшение ультраструктурных морфофункциональных характеристик сперматозоидов. А также обосновано применение Простатилена АЦ для повышения эффективности применения вспомогательных репродуктивных технологий мужчинам в программах прегравидарной подготовки к отцовству.
Ключевые слова : мужское бесплодие, хронический абактериальный простатит, варикоцеле, МАР-тест, индекс фрагментации ДНК,ЭМИС-электронная микроскопия сперматозоидов, Простатилен АЦ, спермограмма
В последние годы нарушения репродуктивной функции у мужчин приобрели особую медицинскую и социальную значимость. Демографические показатели как в России, так и в ряде других стран мира свидетельствуют о прогрессирующем снижении фертильности среди взрослых мужчин. В этой связи несколько раз были пересмотрены нормативы спермограммы в направлении значительного уменьшения числа сперматозоидов: в настоящее время нормальным считается присутствие 15 миллионов сперматозоидов в 1 мл, в отличии от 60 млн несколько десятилетий назад Разумеется, не менее важными являются морфологические характеристики эякулята. Нарушения фертильности у мужчин оценивают как многофакторное состояние, которое может быть связано с наличием органических изменений (варикоцеле, гипогонадизм, крипторхизм и т.д.) органов половой системы, а также возникать вследствие функциональной патозооспермии при хроническом абактериальном простатите.(ХАП). Интерес к возрастным изменениям сперматогенеза продиктован увеличением возраста мужчин, зачастую повторно вступающих в брак и случаев возникновения мужского бесплодия у них, обусловленного простатическими факторами нарушения фертильности. На долю мужского фактора бесплодия в этих семейных парах приходится от трети до половины случаев. В этом случае, с увеличением возраста все параметры эякулята имеют тенденцию к снижению, что особенно выражено в группе пациентов 41–50 лет. Возможно, что у мужчин данной возрастной группы в большей степени, чем в других группах, имеются различные сопутствующие заболевания. [1] Наблюдается снижение содержания половых гормонов, уровня параметров сперматогенеза, ухудшение сексуальной функции, что, несомненно, ведет к снижению фертильности. В связи с этим важен поиск новых и эффективных препаратов, комбинированно воздействующих на клиническую составляющую ХАП и улучшающих показатели сперматогенеза у мужчин среднего возраста[2].
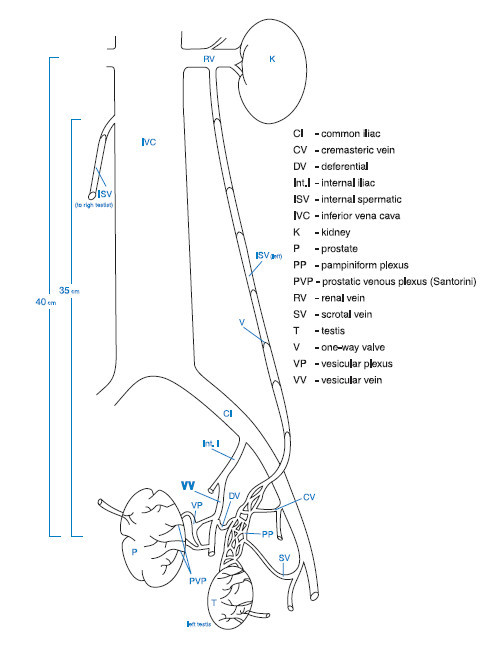
Следует отметить. Что сам по себе ХАП может быть инициирован трансформацией вен таза при варикоцеле. Это подтверждается тем, что существует тесная сосудистая связь между органами мошонки и простатой. Эта связь реализуется через внутреннюю подвздошную вену и/или через вену семявыносящего протока. Такой вено-венозный анастомоз при варикоцеле предполагает влияние эндокринных органов мошонки на тазовые структуры и предстательную железу, приводя к нарушениям ее пролиферации и инициируя патозооспермию [3] рис 1.
Рис 1. Вено-венозные анастомозы органов мошонки и таза. Gat Y. и соавторы (2008)
Gat Y. и соавторы (2008) сообщили о результатах обследования и лечения 28 пациентов с ДГПЖ (с жалобами не менее 2 лет) на фоне двустороннего варикоцеле в возрасте 41–77 лет. Они показали, что при давлении крови в v. testicularis interna 6 mmHg клапаны функционируют и варикоцеле нет. При повышении давления крови в v. testicularis interna до 31,5 mmHg развивается варикоцеле и венозный отток от яичка осуществляется по v. ductus deferens в предстательную железу. При ретроградной флебографии гроздьевидного сплетения с 10 секундной задержкой происходило контрастирование перикапсулярной области простаты, таким образом при повышении венозного давления в яичковой вены происходил сброс крови прямо в простату, где венозное давление ниже [4]. Многие авторы описывают расширение вен парапростатического сплетения на стороне выявленного варикоцеле[5,6]. Во всех случаях диаметр простатического венозного сплетения положительно коррелировал с диаметром вен правого и левого гроздьевидного сплетения. Средний диаметр, пик и скорость антеградного кровотока в простатическом венозном сплетении были выше у мужчин с двусторонним варикоцеле, и ниже у больных с односторонним варикоцеле. В 45% случаев отмечались выраженные локальные изменения в простате в виде фокусов гипоэхогенности, фиброза и кальциноза на стороне варикоцеле. Сексуальные нарушения проявлялись снижением либидо в 20%, недостаточной эрекцией в 48%, нарушением эякуляции в 26% и нарушением оргазма – в 16% случаев. При анализе эякулята патоспермия была обнаружена в 62% случаев, а повышенное содержание лейкоцитов (более 1 млн. в 1 мл.) – в 72% случаев.
Таким образом тесная анатомо функциональная взаимосвязь между варикоцеле и ХАП предусматривает возможность общего патогенетического лечения. Одним из представителей подобной группы препаратов явяется «Простатилен-АЦ». Это суппозитории ректальные разработаны на основе ранее зарегистрированного препарата «Простатилен» суппозитории ректальные, 30 мг, и отличался за счет введения в композицию цинка аргинил-глицината 0,18 г.
Для оценки эффективности влияния простатилена-АЦ на качество жизни, копулятивного цикл мужчины, морфофункциональных показателей сперматозоидов и восстановление фертильности мужчины мы провели собственное исследование.
Материалы и методы. В исследование были включены 30 мужчин в возрасте 30-45 лет(средний возраст 36,2±5,3 года ) с ХАП и мужским фактором бесплодия в браке. Из них 15 больных с ХАП и секреторным типом бесплодия (1-я группа) средний возраст 35,2±4,3 года, 15 мужчин с бесплодием, обусловленным ХАП и варикоцеле в послеоперационном периоде (2-я группа) (средний возраст 33,6±3,3 года).
Таблица 1. Распределение больных по возрасту.
| Группа/возраст | 30-35 | 35-40 | 40-45 |
| 1группа-ХАП секреторное бесплодие | 3 | 4 | 8 |
| 2-ХАП После варикоцелэктомии | 7 | 5 | 3 |
Давность мужского фактора бесплодия колебались от 1 до 4,5 лет и в среднем достигали 2,8±1,6 лет. Пациенты первой группы получали простатилен-АЦ в виде суппозиторий ректальных в течении 10 дней. Пациенты второй группы получали простатилен-АЦ в виде суппозиторий ректальных в течении 20 дней.
Критерии включения:
- Мужской пол.
- Возраст 30-45 лет.
- Признаки ХАП и варикоцелэктомии в анамнезе
- Секреторная форма бесплодия (олигозооспермия, астенозооспермия, тератозооспермия и различные нарушения акросомальной реакции — изолированно или в сочетании).
- Отсутствие беременности в браке (более 12 месяцев половой жизни без контрацепции).
- Отсутствие инфекций репродуктивного тракта (Chlamydia trachomatis, Ureaplasma urealyticum, Mycoplasma hominis, Trichomonas vaginalis), диагностированных методом полимеразной цепной реакции.
- Отсутствие лабораторных признаков бактериального простатита
- Концентрация сперматозоидов не менее 10 млн/мл.
- Отсутствие травм половых органов.
- Отсутствие выраженной соматической патологии.
- Способность пациента понять суть исследования и дать письменное согласие на участие в клиническом исследовании.
Критерии исключения:
- Азо- и криптозооспермия
- Гиперчувствительность к компонентам препарата.
- Возраст младше 30 и старше 45 лет.
- Алкогольная или наркотическая зависимость.
- Повышенная чувствительность к любому из компонентов препарата.
- Нарушения функции печени и почек.
- Участие в другом клиническом исследовании в последние 3 месяца.
Активный период наблюдения составил 3 месяца и включал в себя контрольные исследования на 1-ый и 30-ый день. . Общий период наблюдения за исследуемой группой составил 3 месяца.
Схема исследовательских действий представлена в таблице №2.
Таблица № 2. Схема исследовательских действий.
| № п/п | V1 | V2 | V3 | |
| 1 | Клинико-лабораторная диагностика, шкала оценки NIH-CPSI IPSS,L МИЭФ 5 | + | + | + |
| 2 | Спермограмма | + | + | + |
| 3 | Определение антиспермальных антител (АСАТ) | + | + | |
| 4 | Тест на фрагментацию ДНК | |||
| 5 | Электронное микроскопическое исследование эякулята(ЭМИС) | + | + | |
| 6 | Триплексное ультразвуковое исследование мошонки и соноэластография мошонки | + | + | |
| 7 | Трансректальное УЗ и соноэластография простаты | + | + | |
| 8 | Мониторинг переносимости препарата | + | + |
(V1-первое посещение,V2 второе обращение на 30,V3-90 день лечения)
Половые гормоны исследовались на иммунохемилюминисцентном анализаторе Ассess 2, производства Beckman Coulter, США. Биохимические исследования проводились на анализаторе Advia-1200. Сбор и анализ эякулята проводили в соответствии с критериями ВОЗ 2010 года . Одномоментно исследовали спермограмму, оценку морфологии сперматозоидов по строгим критерия Крюгера; МАР-тест, НВА-тест (индекс зрелости сперматозоидов); анализ фрагментации ДНК сперматозоидов. Отклонения в параметрах кодировали: нарушения жидкой части эякулята (повышение вязкости и\или уменьшение объема эякулята и\или увеличение времени разжижения эякулята); агглютинация (слипание сперматозоидов); олигозооспермия (снижение концентрации < 15 млн\мл и\или общего количества < 39 млн.); астенозооспермия (доля прогрессивно-подвижных < 32 %, снижение подвижности в динамике через 2 часа, снижение степени подвижности < 2); гемоспермия; лейкоспермия (лейкоциты ≥1 млн\мл.); некроспермия (доля живых сперматозоидов < 58%); тератозооспермия (доля морфологически нормальных форм сперматозоидов < 4% и\или повышение индексов дефектности сперматозоидов и\или тератозооспермии (>1,6); нарушение МАР-теста (при уровне антител > 10% ); нарушение НВА-теста (при уровне < 80%); нарушение по уровню фрагментации ДНК (> 15%); Фрагментация ДНК в сперматозоидах у пациентов различных групп
выявление методом TUNEL.
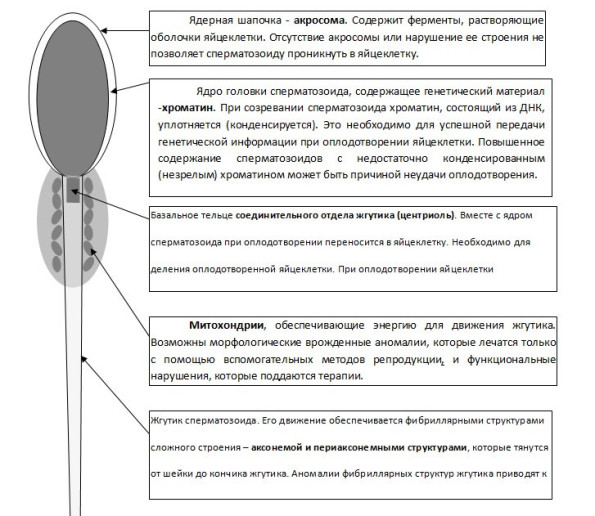
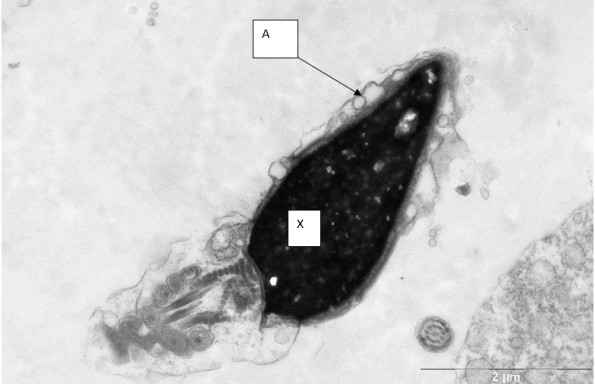
При ЭМИС оценивали содержание интактных головок нормальной формы с нормальным строением хроматина и акросомы (нормативные показатели - 4%). Определяли содержание сперматозоидов с цитоплазматической каплей на головке и на шейке. Определяли содержание сперматозоидов с недостаточно конденсированным «незрелым» хроматином (нормативные показатели – не более 30%) и сперматозоидов с прореагировавшей акросомой, т.е. прошедшей акросомной реакцией (нормативные показатели – не более 20%), а также содержание сперматозоидов с аномалиями морфологии аксонемы жгутика (нормативные показатели – не более 30%) (рис. 2).
Рис1.Схема строения сперматозоида.
Всем больным с патозооспермией проводилась ультразвуковая эластография простаты,мошонки до и после лечения. Исследования выполняли на ультразвуковых приборах, Acuson S-3000, компании Симонс.
Анализ полученных данных проводили с использованием программы IBM Statistics SPSS.
Результаты. Полученные нами результаты свидетельствуют о комплексном влиянии простатилена АЦ на качество жизни и сперматогенез c ХАП. Изменения шкалы IPSS с 15,4 ±4,2 до 7,5± 3,1 и качества жизни с L-3,4±1,1 до L-1,3±0,6 позволило убедительно подтвердить его улучшение в первой группе. В второй подобные изменения были выражены менее существенно с IPSS= 13,4 ±3,6, L-2,9±0,9 до лечения и с 8,8 ±3,2 и качества жизни с L-2±1,1(p<0,005) после лечения. Несколько улучшились показатели эректильной функции по сравнению с исходными данными в группах до лечения. В 1-й группе до лечения МИЭФ-5 = 18,9 ± 3,1, после лечения 21,5± 4,6, В 2-й группе до лечения МИЭФ-5 = 16,4 ± 5,3, после лечения 19,5± 2,6.
По результатам сравнительного анализа данных спермограмм в обеих группах выявлено, что объем эякулята после лечения в среднем увеличился на 61,4 %, в большей степени за счет первой группы больных. Концентрация сперматозоидов в 1 мл возросла на 32,5 % в первой группе и на 25% во второй группе. Быстрая подвижность сперматозоидов (А) выросла в первой группе на 100%, а во второй на 62%, медленное поступательное движение сперматозоидов уменьшилось в первой группе на 34%, во второй на 18% (p<0,05). Прирост вычислялся по формуле: [(х1-х2)/х2]*100% ( таблица 3,4), где х1 – достигнутый результат, х2 – исходный показатель.
Таблица 3. Результаты обследования пациентов с патоспермией до лечения
| Название группы | Объем эякулята до лечения (мл) | Количество сперма-тозоидов в 1 мл эякулята до лечения (млн. в 1 мл) | Подвижность сперма-тозоидов до лечения (быстрое поступательное движение) А, % | Медленное поступательное движение до лечения В,% | Морфология спермато-зоидов до лечения (нормальные формы), % | р |
| 1 группа Секреторное бесплодие | 3,9 ±1,07 | 74,03 ±79,15 | 18,0 ±0,18 | 18,0 ±0,10 | 22 ±0,2 | 0,05 |
| 2 группа После варикоце-лэктомии | 2,88 ±1,52 | 60,0 ±66,6 | 23,0 ±0,14 | 24,0 ±0,031 | 33,0 ±0,2 | 0,04 |
| Общая | 3,39 ±1,38 | 67,0 ±62,3 | 20,0 ±0,15 | 21,0 ±0,07 | 28,0 ±0,2 | 0,04 |
Таблица 4. Результаты обследования пациентов с патоспермией после лечения
| Показатели спермо-граммы | Объем эякулята после лечения (мл) | Количество сперма-тозоидов в 1 мл эякулята после лечения (млн. в 1 мл) | Подвижность сперма тозоидов после лечения (быстрое поступательное движение) А, % | Медленное поступательное движение после лечения В, % | Морфология сперма-тозоидов после лечения (нормальные формы), % | р |
| 1 группа Секреторное Бесплодие ХАП | 4,49 ±1,08 | 94,15 ±73,59 | 11,0 ±0,07 | 11,0 ±0,07 | 42,0 ±0,21 | 0,05 |
| 2 группа ХАП После варико-целэктомии | 3,46 ±1,67 | 74,1 ±24,45 | 22,0 ±0,1 | 22,0 ±0,1 | 51,0 ±025 | 0,04 |
| Общая | 4,02 ±1,49 | 84,12 ±54,35 | 38,0 ±0,15 | 16,0 ±0,1 | 47,0 ±0,22 | 0,04 |
У больных обеих групп после лечения простатиленом-АЦ было обнаружено значительное снижение показателя MAR-теста более выраженное в второй группе :в первой группе с 3(20%) больных до 1-(8,4%), в второй группе с 5(33%) до 2(16,8%).
Таблица 5. Фрагментация ДНК в сперматозоидах у пациентов различного возраста выявление методом TUNEL до лечения
| Группы/возраст, % фрагментации до и после лечения | 30-35 | 35-40 | 40-45 |
| % фрагментации | % фрагментации | % фрагментации | |
| до | после | до | после | до | после | |
| 1 группа | 24,8±9,2 | 15,2±2,4 | 31±2,2 | 17±3,1 | 47±2,1 | 23±4,3 |
| 2 группа | 15±2,4 | 12,7±2,4 | 23±4,1 | 15±3,1 | 35±2,1 | 18±2,4 |
| N=30 | р<0,05 | р<0,05 | р<0,05 | р<0,05 | р<0,05 | р<0,05 |
Повышенное содержание сперматозоидов с фрагментацией ДНК выявлено в у подавляющего большинства больных (17 пациентов). Содержание сперматозоидов с фрагментацией ДНК увеличивалось с возрастом и при наличии сопутствующего оперированного ранее варикоцеле. После лечения простатиленом-АЦ в двух группах численность больных с повышенным содержанием сперматозоидов с фрагментацией ДНК составила 6 пациентов (2 а первой группе и 4- из второй группы).
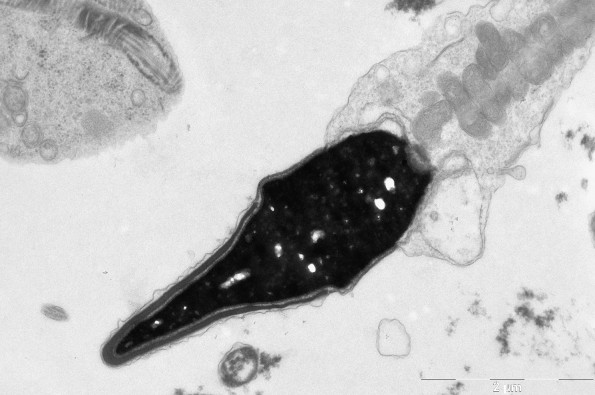
Проведенное ультраструктурное исследование сперматозоидов 5 пациентов 2 группы больных (ХАП и варикоцеле) показало повышенное содержание сперматозоидов с цитоплазматической каплей на головке и на шейке (рис. 3, 4), которое снизилось после лечения во всех образцах. Повышенное содержание сперматозоидов с нарушением конденсации хроматина (более 30%) до лечения было выявлено в образцах №2 и №5 (38% и 47%) и нормализовалось после лечения (16% и 24%, соответственно). Повышенное содержание сперматозоидов с деградацией акросомы (рис.5) выявлено в образцах №1, 3, 4 и 5 (23%, 23%, 40% и 58%), нормализовалось после терапии в образцах №1, 3 и 5 (15%, 17%, 13%, соответственно) и уменьшилось в образце №4 (с 40% до 30%).
Содержание сперматозоидов с аномалией аксонемы жгутиков до лечения было повышено в образце №5 (57%), и снизилось после лечения до нормативных показателей (14%).
Содержание сперматозоидов с интактными головками (рис. 6) увеличилось после терапии в образцах №№ 2, 3, 4 и 5.
Таблица 6. Результаты ЭМИС образцов экулята пациентов 2 группы (ХАП и варикоцеле)
| N | Терапия | Интактные головки | Нарушение конденсации хроматина % | Акросомная реакция % | Цитопл капли на шейке и головке % | Аномалии аксонема (%) |
1 | до | 3 | 19 | 23 | 18 | 9 |
| после | 3 | 23 | 15 | 10 | 8 | |
2 | до | 0 | 38 | 15 | 8 | 12 |
| после | 8 | 16 | 3 | - | 13 | |
3 | до | 4 | 25 | 23 | 35 | 19 |
| после | 8 | 14 | 17 | 23 | 11 | |
4 | до | 0 | 20 | 40 | 24 | 27 |
| после | 3 | 21 | 30 | 15 | 17 | |
| 5 | до | 0 | 47 | 58 | 28 | 57 |
| после | 6 | 24 | 13 | 15 | 14 |
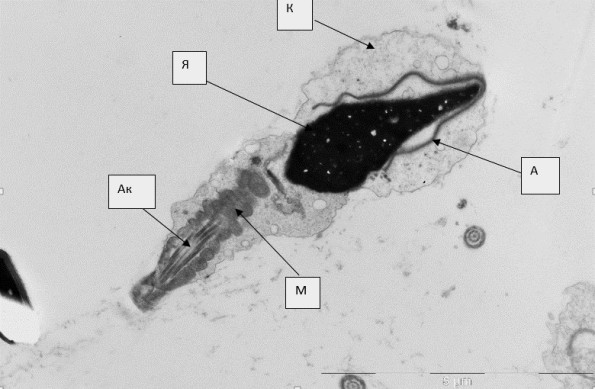
Рис.3. Сперматозоид с ядром нормальной морфологии (Я) и цитоплазматической каплей на головке (К). А – акросома с расширенным перинуклеарным пространством, Ак – аксонема жгутика, М – митохондрии среднего отдела жгутика
Рис.4. Сперматозоид с цитоплазматической каплей на шейке (Ц). Я – ядро, А. акросома, Ак – аксонема жгутика, М – митохондрии среднего отдела жгутика.
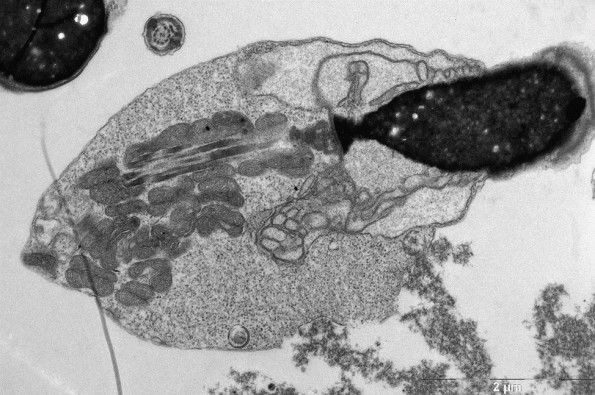
Рис. 4. Сперматозоид с прореагировавшей акросомой (А)). Х – хроматин.
Рис. 6. Типичный сперматозоид с интактной головкой нормальной формы. Х – конденсированный хроматин, А – акросома, М – митохондрии среднего отдела жгутика.
Обсуждение. Улучшение качества жизни и морфо-функциональных характеристик сперматозоидов у мужчин с СХТБ( ХАП) возможно путем патогенетического применения «Простатилен-АЦ» суппозиториев ректальных.
Этот многокомпонентный препарат является оптимальным для копулятивного цикля мужчины и в программах предгравидарной подготовки мужчин к отцовству, особенно после 30 лет. Простатилен-АЦ» улучшает микроциркуляции в органах малого таза, в том числе предстательной железе, уменьшает степень ее отека, застой секрета и лейкоцитарную инфильтрацию ткани железы, снижает активность простатической кислой фосфатазы и белков острой фазы воспаления – церуллоплазмина и С-реактивного белка, ингибирует активность изофермента циклооксигеназы 2, устраняет болевой синдром, оказывает антиоксидантное действие, а также благодаря антиагрегантной активности, препятствует развитию тромбоза венул предстательной железы. Данные свойства проявляются уменьшением проявлений ХАБ в виде снижения симптоматики по шкале IPSS в исследованных группах от 50% в 1-группе до 43 % во второй группе больных. На фоне лечения несколько улучшаются показатели эректильной функции ее рост составил от 21% в первой группе до 14 во второй группе. дополнительное влияние цинка аргинил-глицината нормализует не только секреторную функцию предстательной железы, , но главное, увеличивает число прогрессивно-подвижных форм сперматозоидов и их морфологически нормальных форм, а так же способствует выраженному снижению в эякуляте уровня антиспермальных антител и фрагментации ДНК сперматозоидов. Так до лечения в указанных группах больных мы наблюдали снижение показателя MAR-теста более выраженное в второй группе, чем в первой группе с 3(20%) больных до 1-(8,4%), в второй группе с 5(33%) до 2(16,8%). Важным вопросом в изучении фертильности мужчин с патозооспермией является Индекс фрагментации ДНК сперматозоидов. В нашем исследовании он составил от 24% до 47 % больных в первой и второй группах до лечения , а после терапии составил 6 больных 2 и 4 в соотвествующих группах. Данный критерий является важным в репродуктивной медицине. Продолжается все более глубокое изучение ультраструктурных особенностей половых клеток, оказывающих огромное влияние на процесс зачатия и вынашивания. Фрагментация ДНК сперматозоидов является одним из маркеров ультраструктурного повреждения наследственной информации, отвечающей за развитие эмбрионов и вероятность рождения здорового ребенка. Метаанализ 16 исследований, посвященных проблеме потери беременности (2969 супружеский пар), продемонстрировал значительное увеличение частот выкидыша у женщин при условии высокого уровня фрагментации ДНК в сперматозоидах мужчин по сравнению со случаями низкого уровня фрагментации ДНК. В 2012 г опубликовано исследование, посвященное проблеме идиопатического привычного невынашивания беременности, результаты которого показали достоверно более высокий уровень фрагментации ДНК сперматозоидов в группе пар с потерей беременности по сравнению с группой контроля. Основной причиной повышения уровня фрагментации ДНК в нашем случае являлся окислительный стресс в сперматозоидах и недостаточность активности собственных антиоксидантных систем под действием повреждающих факторов внешней и внутренней среды.
Морфологические эффекты препарата Простатилен АЦ в виде улучшения структурно-функциональных изменений сперматозоидов, которое мы регистрировали в виде уменьшения и/или исчезновения цитоплазматической капли на головке и шейки сперматозоидов 1 группе, снижение количества с прореагировавшей акросомой сперматозоидов должны дальше использоваться врачами урологами и репродуктологами.
Выводы. Простатилен АЦ является эффективным препаратом для улучшения качества жизни и морфофункциональных характеристик сперматозоидов мужчины. Применение Простатилен АЦ повышает эффективность применения вспомогательных репродуктивных технологий мужчинам в программах прегравидарной подготовки к отцовству.
Cписок литературы
- В. В. Евдокимов, О. Б. Жуков, Бабушкина Е.В. Анализ параметров эякулята у мужчин в различных возрастных группах. №2 Андрология генит хирургия том 17 , 2016 стр 39-42
- Цуканов А.Ю., Ляшев Р.В. Нарушение венозного кровотока как причина хронического абактериального простатита (синдрома хронической тазовой боли). Урология, 2014, № 4, стр. 37-42
- Варикозная болезнь органов таза мужчины. Андрология и генитальная хирургия №4 2016 стр 71-75. О.Б. Жуков и соавтор
- Gat Y., Gornish M., Heiblum M., Joshua S. Reversal of benign prostate hyperplasia by selective occlusion of impaired venous drainage in the male reproductive system: novel mechanism, new treatment. Andrologia. 2008;40(5):273-81.
- Неймарк А.И., Попов И.С., Газаматов А.В. Особенности микроциркуляции предстательной железы и гонад у юношей, страдающих изолированным варикоцеле и варикоцеле в сочетании с тазовой конгестией. Экспериментальная и клиническая урология, №2, 2013, стр. 56-60.
- Цуканов А.Ю., Ляшев Р.В. Варикозная болезнь малого таза как причина патоспермии и пути ее коррекции. Андрология и генитальная хирургия. 2, 20 Стр. 74-80.
1Научно-исследовательский институт урологии и интервенционной радиологии им. Н. А. Лопаткина – филиал ФГБУ «Национальный медицинский исследовательский радиологический центр» Минздрава России; Россия, 105425, Москва, ул. 3-я Парковая, 51, стр. 4
2НИИ физикохимической биологии им. А. Н. Белозерского МГУ, ведущий научный сотрудник ФГБУ Медико-генетического научного центра.НИИ физико-химической биологии
Контакты: Олег Борисович Жуков ob.zhukov@yandex.ru
Авторы: О.Б.Жуков, В.В. Евдокимов, Е.Е Брагина