Под председательством профессора Г. П. Арутюнова 14 апреля 2013 г. в Москве состоялось заседание Экспертного совета, члены которого обсудили результаты последних клинических исследований стандартизированного препарата ω‑3 поли ненасыщенных жирных кислот (ПНЖК) Омакора. С докладами выступили профессора H. Rupp (университет им Оттофон Герике, Магдебург, Германия), J. Halcox (университет Кардиффа, Великобритания), Ю. А. Карпов (Российский кардиологический научно‑производственный комплекс, Москва), Ю. М. Лопатин (Волгоградский государственный медицинский университет), С. В. Моисеев (Первый Московский государственный медицинский университет имени И. М. Сеченова).
Омакор – показания к применению и отличия от других препаратов w-3 ПНЖК
Омакор – это стандартизированный препарат, содержащий высокую концентрацию высокоочищенных этиловых эфиров ω‑3 полиненасыщенных жирных кислот (ПНЖК): 46 % этилового эфира ЭПК и 38 % этилового эфира ДГК, который производится в соответствии с жесткими требованиями надлежащей производственной практики (GMP – Good Manufacturing Practice). В процессе производства лекарственное вещество очищается от различных примесей. Эффективность и безопасность Омакора изучались в рандомизированных плацебо‑контролируемых исследованиях, на основании которых официальными органами США, Европы и России были зарегистрированы показания к его применению вторичная профилактика ИМ и гиперТГ. Другие препараты ω‑3 ПНЖК представляют собой не лекарственные средства, а пищевые добавки, которые могут содержать не только действующее вещество, но и различные примеси (например, диоксины). Пищевые добавки не изучались в клинических исследованиях, поэтому какие‑либо доказательства их эффективности и безопасности отсутствуют.
Новые данные о механизмах действия w-3 ПНЖК
В экспериментальных исследованиях установлено, что ω‑3 ПНЖК дают плейотропные эффекты, в том числе антиаритмический, гипоТГ, антитромботический, противовоспалительный и другие, которые объясняются действием различных механизмов [1]. В низких микромолярных концентрациях ω‑3 ПНЖК обладают антиаритмическими свойствами, связанными с прямым блокирующим действием на натриевые, калиевые и кальциевые каналы. Антиаритмический эффект развивается быстро, так как он не требует биотрансформации полиненасыщенных жирных кислот [2]. Кроме того, ω‑3 ПНЖК встраиваются в клеточные мембраны и оказывают замедленное, но длительное противовоспалительное и антиатерогенное действие, а также модулируют экспрессию генов, участвующих в развитии воспалительного ответа (ингибирование провоспалительного ядерного фактора kB и активация противовоспалительного фактора NR1C3). Установлены сцепленные с G‑белком GPR120 рецепторы, которые частично опосредуют эффекты ω‑3 ПНЖК [3]. Механизмы противовоспалительного действия ω‑3 ПНЖК включают в себя ингибирование хемотаксиса лейкоцитов, экспрессии молекул адгезии, образование биологически активных веществ, в том числе эйкозаноидов и локальных медиаторов (резолвинов, протектинов), которые обладают мощными противовоспалительными свойствами [4]. Противовоспалительное действие ω‑3 ПНЖК установлено не только в экспериментальных, но и в клини‑ ческих исследованиях. Например, у 121 больного каротидным атеросклерозом применение этиловых эфиров ω‑3 ПНЖК в течение в среднем 21 дня перед эндар‑ терэктомией привело к увеличению содержания ω‑3 ПНЖК в бляшках, которое сопровождалось снижением числа пенистых клеток и Т‑лимфоцитов, уменьшением воспаления и повышением стабильности бляшек [5].
Нестабильность (уязвимость) атеросклеротической бляшки повышает риск ее повреждения, которое является причиной образования тромба и развития ИМ.
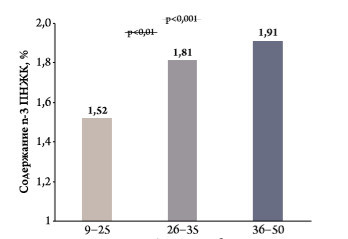
Поражение сердца, сопровождающееся дилатацией его камер, ассоциируется с низкими уровнями ω‑3 ПНЖК [6]. В исследовании у 331 больного СН была выявлена обратная корреляция между содержанием ω‑3 ПНЖК и размерами ЛЖ и левого предсердия и ФВ ЛЖ (рис. 1) [7]. Хотя остается неясным, что является первичным дефицит ω‑3 ПНЖК или поражение миокарда, тем не менее имеются данные, подтверждающие клиническое значение недостаточности ω‑3 ПНЖК. Например, в исследовании Physicians' Health Study у мужчин с более высокими уровнями ω‑3 ПНЖК в крови риск внезапной смерти был на 72–81 % ниже, чем у мужчин с низким их содержанием [8]. У больных неишемической дилатационной кардиомиопатией длительная терапия Омакором привела к улучшению систолической функции и уменьшению размера ЛЖ [9], а в исследовании GISSI‑Prevenzione эффективность Омакора в профилактике внезапной смерти после ИМ была выше у пациентов с систолической дисфункцией ЛЖ [10].
Таким образом, недостаточность ω‑3 ПНЖК, по‑видимому, вносит вклад в прогрессирование дисфункции сердца и СН и в развитие угрожающих жизни аритмий, что обосновывает терапию препаратами ω‑3 ПНЖК.
Почему некоторые клинические исследования не подтвердили эффективность Омакора?
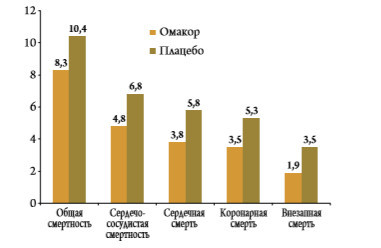
Эффективность и безопасность Омакора в дозе 1 г/сут. в профилактике сердечно‑сосудистых исходов были установлены в двух крупных рандомизированных плацебоконтролируемых исследованиях GISSI‑ Prevenzione и GISSI‑HF. В первое исследование были включены 11324 пациента, перенесшие ИМ (≤3 месяцев назад) [11]. По сравнению с контрольной группой лечение Омакором привело к достоверному снижению суммарной частоты смерти от сердечно‑сосудистых причин, нефатальных ИМ и инсульта на 20 % (р=0,008), а также риска смерти от любых и сердечно‑сосудистых причин на 20 и 30 % соответственно и риска внезапной смерти на 45 % (рис. 2). Снижение риска внезапной смерти достигло статистической значимости уже через 4 месяца после начала лечения (на 53 %, p=0,048) [12].
В исследование GISSI‑HF были включены 7 046 пациентов с СН II–IV ФК [13]. Лечение Омакором привело к статистически значимому снижению общей смертности на 9% (р=0,041), а также суммарной частоты смерти вследствие любых причин или госпитализаций по поводу ССЗ на 8 % (р=0,009). В выборке пациентов, которые выполняли требования протокола (т. е. продолжали лечение в течение, по крайней мере, 80% от намеченного срока), общая смертность снизилась на 14% (р=0,004). Кроме того, было отмечено достоверное снижение сер‑ дечно‑сосудистой смертности на 10% (р=0,045) и частоты госпитализаций по поводу ССЗ на 7% (р=0,026).
В то же время эффективность ω‑3 ПНЖК не была подтверждена в исследованиях ORIGIN, OPERA и OMEGA. В исследовании ORIGIN изучалась эффективность первичной / вторичной профилактики сердечно‑сосудистых исходов у 12 536 пациентов с СД 2 типа с гликемией натощак или нарушенной толерантностью к глюкозе и высоким риском сердечно‑сосудистых осложнений [14], а в исследовании OPERA эффективность кратковременного приема ω‑3 ПНЖК в профилактике развития фибрилляции предсердий после аортокоронарного шунтирования [15]. Следует отметить, что в последнем исследовании в группе ω‑3 ПНЖК через 30 дней было выявлено достоверное снижение риска развития артериальных тромбоэмболий (р=0,047) и смерти от любых причин (р=0,01), которые служили вторичными конечными точками. В плацебо контролируемом исследовании OMEGA [16] эффективность ω‑3 ПНЖК 1 г / сут изучали у 3851 больного острым ИМ. В течение 1 года достоверной разницы риска развития внезапной сердечной смерти и других неблагоприятных исходов между группами ω‑3 ПНЖК и плацебо не выявили. Однако в этом исследовании частота исходов оказалась ниже предполагаемой, поэтому запланированная статистическая мощность не была достигнута. Это означало, что для подтверждения эффективности ω‑3 ПНЖК в исследование следовало бы включить намного больше больных, что было невозможным по техническим причинам.
Наиболее вероятная причина неоднозначности полученных данных неоднородность клинических исследований. Эффективность ω‑3 ПНЖК изучается по очень широкому спектру показаний. Например, в исследованиях GISSI‑Prevenzione и GISSI‑HF, подтвердивших эффективность Омакора, препарат применяли с целью вторичной профилактики сердечно‑сосудистых исходов, а в исследовании ORIGIN, результаты которого оказались отрицательными, оценивали в основном эффективность первичной профилактики. Пользу ω‑3 ПНЖК пытались доказать у здоровых людей, больных ИМ, СН, фибрилляцией предсердий, у пациентов с имплантируемыми кардиовертерамидефибрилляторами, каротидным атеросклерозом, после аортокоронарного шунтирования и т. д. В разных исследованиях отличались дозы ω‑3 ПНЖК (от 1 до 5 г/сут. и более) и длительность их применения. Например, в исследованиях GISSI‑Prevenzione и GISSI‑HF длительность лечения Омакором достигала 3–4 лет, в то время как в исследовании OPERA его применяли в течение около 2 недель. Вариабельными были и конечные точки исследований: сердечно‑сосудистые исходы, рецидивы фибрилляции предсердий, развитие ее после аортокоронарного шунтирования, функция ЛЖ, частота срабатывания кардиовертера‑дефибриллятора и т. д. В некоторых исследованиях изучалась эффективность стандартизированного препарата ω‑3 ПНЖК, в других оценивалось их потребление с пищей на основании вопросников. Значительно отличались даже исследования, в которых эффективность ω‑3 ПНЖК изучали по одному и тому же показанию. L. Bianconi с соавт. [17] не подтвердили эффективность ω‑3 ПНЖК в дозе 2 г / сут в профилактике рецидивов персистирующей фибрилляции предсердий после электрической кардиоверсии в рандомизированном исследовании у 204 больных. В этом исследовании у большинства пациентов отсутствовали выраженные структурные изменения сердца. Около трети из них были больные с изолированной фибрилляцией предсердий, а средняя ФВ ЛЖ составляла около 58 %. В то же время в другом исследовании [18] применение Омакора в той же дозе (2 г / сут) в течение 1 года привело к увеличению вероятности сохранения синусового ритма после кардиоверсии почти в 2 раза по сравнению с плаце‑бо (0,62 и 0,36 соответственно, р=0,0001). В этом исследовании доля пациентов с изолированной фибрилляцией предсердий составляла менее 10 %, примерно у трети имелось дилатационное поражение сердца, а средняя ФВ ЛЖ составляла около 50 %. Таким образом, в исследовании S. Nodari с соавт. преобладали пациенты с более выраженными структурными изменениями сердца, которые, как указано выше, ассоциируются с дефицитом ω‑3 ПНЖК, что могло способствовать повышению эффективности заместительной терапии.
Очевидно, что при изучении ω‑3 ПНЖК по столь широкому спектру показаний не стоило ожидать, что результаты всех исследований будут положительными, как и попытки их метаанализа [19]. E. Rizos с соавт. [20] при метаанализе всех достаточно длительных (>1 года) рандомизированных исследований не подтвердили эффективность ω‑3 ПНЖК в первичной или вторичной профилактике сердечно‑сосудистых исходов, в то время как при объединении достаточно однородных рандомизированных плацебо контролируемых исследований, в которых изучалось влияние ω‑3 ПНЖК на показатели функции сердца (ФВ и объем ЛЖ, ФК по NYHA и пиковое потребление кислорода при физической нагрузке) у 825 больных ХСН, было установлено достоверное улучшение показателей сократимости ЛЖ [21]. Противоречивые результаты клинических исследований не опровергают эффективность лекарственных препаратов, установленную по определенным показаниям в крупных рандомизированных двойных слепых исследованиях.
Исследование GPRD
Исследование GISSI‑Prevenzione, подтвердившее эффективность Омакора во вторичной профилактике ИМ, проводилось более 10 лет назад, поэтому некоторые авторы высказывают сомнение по поводу актуальности полученных данных для современной практики лечения таких больных. Сегодня, конечно, сложнее подтвердить дополнительный профилактический эффект того или иного препарата у пациентов, которые получают несколько лекарственных средств, достоверно улучшающих прогноз. Однако Омакор по механизму действия отличается от других препаратов, которые используются у больных ИМ, поэтому трудно себе представить, каким образом они могут нивелировать его эффективность. Кроме того, эффективность многих профилактических лекарственных средств была установлена много лет назад (тиазидные диуретики, аспирин, β‑адреноблокаторы, иАПФ и др.), что нисколько не снижает их ценности для современной кардиологии. Следует отметить, что результаты изучения других профилактически препаратов также были противоречивыми. Например, в крупных исследованиях GISSI‑HF и CORONA розувастатин не снижал риск неблагоприятных исходов у больных СН [22, 23], что не может служить основанием для отказа от его применения у больных коронарным атеросклерозом.
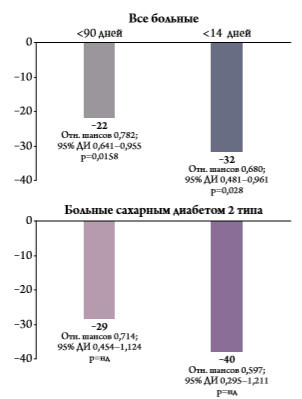
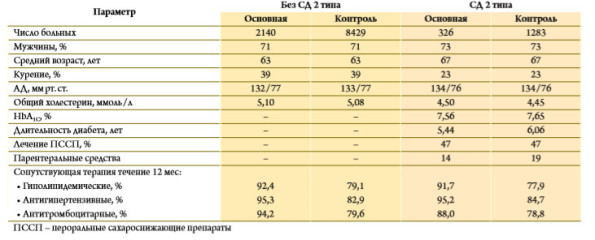
Тем не менее эффективность терапевтических вмешательств желательно периодически переоценивать с учетом изменений подходов к лечению и профилактике ССЗ. В начале 2013 года были опубликованы результаты крупного ретроспективного исследования, в котором изучалась эффективность Омакора во вторичной профилактике ИМ у больных СД 2 типа и без диабета [24]. Отбор больных осуществляли в базе данных General Practice Research Database, в которую включены более 11 млн. пациентов (700 врачей общей практики), проживающих в различных частях Великобритании. Основную группу составили 2466 пациентов с первичным ИМ, которым в первые 90 дней после появления симптомов был назначен Омакор в дозе 1г/сут. (у 328 из них имелся СД 2 типа). Каждому пациенту подбирали по 4 больных ИМ, не получавших Омакор, на основании клинических и демографических показателей (наличие первичного ИМ, пол, возраст, курение, наличие СД). Таким образом, в контрольную группу были включены 9 712 пациентов. Чтобы учесть возможные различия между группами (неизбежные в ретроспективном исследовании), использовали модель пропорциональной регрессии Кокса, позволяющую рассчитать скорректированный риск неблагоприятных исходов (например, с поправкой на сопутствующую терапию), и проводили анализ чувствительности. Первичной конечной точкой анализа была смерть от любых причин. Авторы не изучали другие неблагоприятные исходы, учитывая трудности, возникающие при ретроспективной оценке конечных точек. По исходным клиническим и демографическим показателям группы больных, получавших и не получавших Омакор, были сопоставимыми (табл. 1). Подавляющее большинство из них принимали другие необходимые профилактические средства, в том числе блокаторы агрегации тромбоцитов, статины и антигипертензивные препараты. Частота сопутствующей терапии была достоверно выше в основной группе. Во всей выборке нескорректированное отношение шансов смерти от любых причин при лечении Омакором снизилось на 30 %. После внесения поправки на разницу сопутствующей терапии благоприятный эффект препарата несколько уменьшился, однако снижение скоррек‑ тированного отношения шансов оставалось клинически и статистически значимым на 21 % (отношение шансов 0,782; 95 % доверительный интервал 0,641–0,955; р=0,0158; рис. 3). Еще более значительного снижения смертности (на 32 %) удалось добиться у больных, у кото‑ рых лечение Омакором было начато в первые 14 дней после ИМ (отношение шансов 0,680; 95 % доверительный интервал 0,481–0,961; р=0,028). В выборке больных СД 2 типа общая смертность была примерно в 2 раза выше, чем у всех пациентов, включенных в исследование. У пациентов с СД 2 типа лечение Омакором привело к снижению отношения шансов смерти от любых причин на 29 %, однако этот эффект не достиг статистической значимости вследствие недостаточного размера выборки. Результаты анализа чувствительности показали, что эффективность Омакора во вторичной профилактике ИМ не зависела от сопутствующей терапии.
Исследование OPTIMIZE
Изучение эффективности Омакора во вторичной профилактике ИМ продолжается в многоцентровом наблюдательном открытом исследовании OPTIMIZE, которое проводится в реальной клинической практике в 15 странах, включая Россию. В исследование планируется включить около 4 тыс. больных ИМ с подъемом и без подъема сегмента ST (в первые 3–12 недель), получающих и не получающих Омакор. Задачи исследования включают в себя изучение характеристики больных ИМ в разных странах (демографические показатели, сердечно‑сосудистые ФР, клинико‑инструментальные показатели) и тактики их ведения (тромболизис, первичное чрескожное вмешательство на коронарных артериях, медикаментозная профилактика, другие средства), а также оценка эффективности Омакора (повторный ИМ, ХСН, внезапная смерть, остановка сердца, смерть от сердечно-сосудистых причин, смерть от всех причин). Длительность наблюдения составит 12 месяцев. Набор больных планируется завершить летом 2013 года.
Показания к лечению Омакором
Кому показана терапия Омакором? Лечение Омакором показано больным ИМ с целью улучшения выживаемости, в частности, снижения риска внезапной смерти. Эффективность препарата была установлена в исследовании GISSI‑Prevenzione и подтверждена в ретроспективном исследовании GPRD. Терапию лучше начинать в ранние сроки после инфаркта (предпочтительно в первые 2 недели). Более выраженного эффекта, вероятно, следует ожидать у пациентов с систолической дисфункцией ЛЖ.
Кроме того, Омакор целесообразно применять для улучшения выживаемости больных ХСН со сниженной систолической функцией ЛЖ. Эффективность препарата при СН установлена в исследовании GISSI‑ HF и подтверждается результатами нескольких менее крупных клинических исследований и их метаанализа. Эффективность Омакора при СН с сохранной систолической функцией ЛЖ не изучалась.
В какой дозе назначать Омакор? Эффективность Омакора может зависеть от дозы, поэтому в некоторых исследованиях его применяли в дозе 2г/сут. и более. Тем не менее в двух главных исследованиях суточная доза препарата составляла 1 г. Соответственно, в клинической практике Омакор целесообразно назначать в указанной дозе.
Как долго продолжать лечение? Лечение Омакором, как и любыми другими профилактическими средствами, следует продолжать в течение длительного времени (неопределенно долго). Судить об оптимальной длительности применения Омакора после ИМ сложно, однако в исследовании GISSI‑Prevenzione она составляла 3–4 года.
Заключение
Результаты последних исследований не противоречат известным показаниям (вторичная профилактика ИМ и гиперТГ) к применению ω‑3 ПНЖК в повседневной клинической практике.
Совет Экспертов считает, что применение Омакора наиболее обосновано у пациентов после ИМ с выраженной систолической дисфункцией и высоким риском внезапной сердечной смерти.
Назначать Омакор следует в максимально ранние сроки (желательно в первые 14 дней после острого ИМ).
С учетом результатов исследования GISSI‑Prevenzione терапию следует продолжать в течение неопределенно длительного срока.
Члены экспертного совета:
О. И. Боева (Ставрополь), Н. Ю. Хозяинова (Смоленск), Т. А. Петричко (Хабаровск), С. Л. Жарский (Хабаровск), Е. Л. Федорова (Новосибирск), С. В. Иванов (Барнаул), Ю. В. Шубик (Санкт-Петербург), Е. М. Нифонтов (Санкт-Петербург), А. Г. Обрезан (Санкт-Петербург), И. И. Шапошник (Челябинск), В. М. Щербенев (Пермь), Е. А. Гричук (Екатеринбург), А. А. Симаков (Самара), Е. А. Ацель (Казань), И. С. Петелина (НижнийНовгород), Т. В. Тавровская (Барнаул), Т. В. Тюрина (СанктПетербург), Н. Б. Перепеч (Санкт-Петербург), М. А. Немировская (Москва), Ю. Н. Моисеева (Москва), И. А. Либов (Москва), Т. П. Голубкова (Москва), Н. И. Голубков (Москва), С. И. Татаева (Москва), Е. С. Болбот (Москва), А. А. Карлов (Москва), Э. М. Томаева (Москва), Д. С. Нугманова (Казахстан), К. М. Кошумбаева (Казахстан).
Список литературы.
1. De Caterina R . n-3 fatty acids in cardiovascular disease. N Engl J Med. 2011;364 (25):2439–2450.
2. Leaf A, Xiao YF, Kang JX, Billman GE. Membrane effects of the n-3 fish oil fatty acids, which prevent fatal ventricular arrhythmias. J Membr Biol. 2005;206 (2):129–139.
3. Oh DY, Talukdar S, Bae EJ et al. GPR120 is an omega-3 fatty acid receptor mediating potent anti-inflammatory and insulin-sensitizing effects. Cell. 2010;142 (5):687–698.
4. Calder P. Omega-3 polyunsaturated fatty acids and inflammatory processes: nutrition or pharmacology? Br J Clin Pharmacol. 2013;75 (3):645–662.
5. Cawood AL, Ding R, Napper FL et al. Eicosapentaenoic acid (EPA) from highly concentrated n-3 fatty acid ethyl esters is incorpo rated into advanced atherosclerotic plaques and higher plaque EPA is associated with decreased plaque inflammation and increased stability. Atherosclerosis. 2010;212 (1):252–259.
6. Rupp H, Rupp TP, Alter P, Maisch B . Inverse shift in serum polyunsaturated and monounsaturated fatty acids is associated with adverse dilatation of the heart. Heart. 2010;96 (8):595–598.
7. Rupp H, Rupp TP, Alter P, Maisch B . Mechanisms involved in the differential reduction of omega-3 and omega-6 highly unsaturated fatty acids by structural heart disease resulting in «HUFA deficiency». Can J Physiol Pharmacol. 2012;90 (1):55–73.
8. Albert CM, Campos H, Stamfer MJ et al. Blood levels of long chain n-3 fatty acids and the risk of sudden death. N Engl J Med. 2002;346 (15):1113–1118.
9. Nodari S, Triggiani M, Campia U et al . Effects of n-3 polyunsaturated fatty acids on left ventricular function and functional capacity in patients with dilated cardiomyopathy. J Am Coll Cardiol. 2011;57 (7):870–879.
10. Macchia A, Levantesi G, Franzosi MG et al, for the GISSIPrevenzione Investigators. Left ventricular systolic dysfunction, total mortality, and sudden death in patients with myocardial infarction treated with n-3 polyunsaturated fatty acids. Eur J Heart Fail . 2005;7 (5):904–909.
11. GISSI-Prevenzione Investigators. Dietary supplementation with n-3 polyunsaturated fatty acids and vitamin E after myocardial infarction: results of the GISSI-Prevenzione trial. Lancet. 1999;354 (9177):447–455.
12. Marchioli R, Barzi F, Bomba E. Early protection against sudden death by n-3 polyunsaturated fatty acids after myocardial infarction: time-course analysis of the results of the Gruppo Italiano per lo Studio della Sopravvivenza nell'Infarto Miocardico (GISSI)–Prevenzione. Circulation. 2002;105 (16):1897–1903.
13. Tavazzi L., Maggioni AP, Marchioli R . Effect of n-3 polyunsaturated fatty acids in patients with chronic heart failure (the GISSI-HF trial): a randomised, double-blind, placebo-controlled trial. Lancet. 2008;372 (9645):1223–1230.
14. The ORIGIN trial investigators . n-3 fatty acids and cardiovascular outcomes in patients with dysglycemia. N. N Engl J Med . 2012;367 (4):309–318.
15. Mozaffarian D, Marchioli R, Macchia A et al. Fish oil and postoperative atrial fibrillation: the Omega-3 Fatty Acids for Prevention of Post-operative Atrial Fibrillation (OPERA) randomized trial. JAMA. 2012;308 (19):2001–2011.
16. Rauch B, Schiele R . OMEGA, a randomized, placebo-controlled trial to test the effect of highly purified omega-3 fatty acids on top of modern guideline-adjusted therapy after myocardial infarction. Circulation. 2010;122 (21):2152–2159.
17. Bianconi L, Calò L, Mennuni M et al. n-3 Polyunsaturated fatty acids for the prevention of arrhythmia recurrence after electrical cardioversion of chronic persistent atrial fibrillation: a randomized, double-blind, multicentre study. Europace. 2011;13 (2):174–181.
18. Nodari S, Triggiani M, Campia U et al. n-3 Polyunsaturated fatty acids in the prevention of atrial fibrillation recurrences after electrical cardioversion: A prospective, randomized study. Circulation. 2011;124 (10):1100–1106.
19. Моисеев С. B. n-3 Полиненасыщенные жирные кислоты: о чем свидетельствуют результаты последних мета-анализов? Клин. фармакол. тер. 2013;22 (1):23–28.
20. Rizos EC, Ntzani EE, Bika E et al. Association between omega-3 fatty acid supplementation and risk of major cardiovascular disease events: a systematic review and meta-analysis. JAMA. 2012;308 (10):1024–1033.
21. Xin W, Wei W, Li X. Effects of fish oil supplementation on cardiacfunction in chronic heart failure. A meta-analysis of randomised controlled trials. Heart. 2012;98 (22):1620–1625.
22. Gissi-Hf Investigators . Effect of rosuvastatin in patients with chronic heart failure (the GISSI-HF trial): a randomised, double-blind, placebo-controlled trial. Lancet. 2008;372 (9645):1231–1239.
23. Kjekshus J, Apetrei E, Barrios V et al. Rosuvastatin i in older patients with systolic heart failure. N Engl J Med. 2007;357 (22):2248–2261.
24. Poole CD, Halcox JP, Jenkins-Jones S et al. Omega-3 fatty acids and mortality outcome in patients with and without type 2 diabetes after myocardial infarction: A retrospective, matched-cohort study. Clin Ther. 2013;35 (1):40–51.
Источник: Обрезан А.Г., Арутюнов Г. П., Карпов Ю. А., Лопатин Ю. М., Моисеев В. С."Роль Омакора в современной кардиологии"/ Сердце: журнал для практикующих врачей. Том 12, № 4 (72), 2013 г. с. 259-264