Множественная миелома — multiple myeloma (миеломная болезнь, генерализованная плазмоцитома, болезнь Рустицкого Калера) — диссеминированная плазмоклеточная опухоль, поражающая главным образом костный мозг; часто характеризуется наличием моноклонального иммуноглобулина, белка Бенс-Джонса или и того и другого; плазмоцитарная миелома по классификации ВОЗ [1].
Частота миеломной болезни в странах Европы колеблется от 3 до 5 на 100 000 населения в год. Смертность от миеломной болезни составляет 18% от всех гематологических опухолей. Мужчины и женщины болеют примерно с одинаковой частотой. Максимум заболеваемости приходится на 5-7-е десятилетие жизни, только 3% заболевших моложе 40 лет [2].
Множественная миелома возникает в результате злокачественной пролиферации плазматических клеток, происходящей в основном в костном мозге, а иногда и в экстрамедуллярных очагах. Имеются сообщения и о семейных случаях множественной миеломы, однако доказательств о генетической предрасположенности к данному заболеванию не получено. Одним из вероятных факторов риска развития множественной миеломы является ионизирующая радиация. Этиологическая роль вирусов не установлена.
Миеломная опухоль чаще локализуется в костях таза, позвоночнике, ребрах, костях черепа. У больных выявляется диффузный остеопороз, генерализованный или очаговый остеолиз, обусловленные экспансивным ростом плазмоклеточных опухолей и (или) воздействием фактора, активирующего остеокласты, который продуцирует плазматические клетки. Эстрамедулярные плазмоцитомы встречаются сравнительно редко, но могут поражать любые органы [3].
В течение миеломной болезни выделяют бессимптомный период,
развернутую клиническую и терминальную стадии.
Развитию клинической картины миеломной болезни всегда предшествует бессимптомный период, который имеет различную продолжительность (от 5 до 15 лет, редко — дольше). В этом периоде больные чувствуют себя удовлетворительно, остаются трудоспособными, клинических проявлений поражения внутренних органов и костной системы нет. Однако практически всегда обнаруживаются (обычно при случайном обследовании) высокая СОЭ, М-компонент в сыворотке крови при электрофорезе белков и необъяснимая протеинурия. На этой стадии заболевания количество плазматических клеток в костном мозге еще остается нормальным.
Период выраженных клинических проявлений характеризуется многочисленными субъективными ощущениями и симптомами поражения костей и внутренних органов. Больные жалуются на выраженную общую слабость, снижение трудоспособности, головокружения, усталость к концу рабочего дня, снижение аппетита, похудание, частые рецидивирующие воспалительные заболевания дыхательной системы, боли в костях. Указанные симптомы заставляют больного обратиться к врачу, и обычно на этой стадии клинико-лабораторное обследование больного позволяет поставить диагноз заболевания.
В клинической картине развернутой стадии заболевания можно выделить следующие синдромы:
- синдром костной патологии;
- поражение системы кроветворения (анемический синдром);
- синдром белковой патологии;
- синдром поражения почек (миеломная нефропатия);
- синдром висцеральной патологии;
- синдром вторичного иммунодефицита;
- синдром повышенной вязкости крови;
- неврологический синдром;
- гиперкальциемический синдром.
Терминальная стадия миеломной болезни характеризуется тяжелым клиническим течением, резким обострением всей симптоматики заболевания, выраженным прогрессированием хронической почечной недостаточности вплоть до развития уремической комы, усугублением анемии, тяжелыми инфекционновоспалительными процессами. В терминальной стадии заболевания быстро происходит разрушение костей, миелома прорастает в окружающие мягкие ткани, внутренние органы, мозговые оболочки; резко усиливаются симптомы интоксикации, появляется выраженная лихорадка, больные худеют; возможна трансформация миеломной болезни в агрессивную лимфому или острый плазмобластный лейкоз.
В основе определения стадий множественной миеломы лежат исследования уровня гемоглобина, содержание в сыворотке крови кальция, уровня иммуноглобулинов, величины экскреции с мочой белка Бенс-Джонса и выраженность остеодеструктивного процесса (стадии I, II, III в соответствии с классификацией стадий множественной миеломы по Durie, Salmon, 1975).
Каждая стадия подразделяется на подстадию А и В в зависимости от содержания креатинина в сыворотке крови следующим образом:
I A, II A, III A — содержание креатинина в сыворотке крови < 177 ммоль/л.
I B, II B, III B — содержание креатинина в сыворотке крови > 177 ммоль/л.
Клинико-анатомическая классификация миеломной болезни основана на данных рентгенологического исследования скелета и морфологическом анализе пунктатов и трепанатов костей.
Различают следующие формы миеломной болезни:
а) солитарная миелома (костная или внекостная),
б) генерализованная (множественная) миелома:
- множественно-опухолевая (без диффузного распространения) — 15% всех миелом;
- диффузно-очаговая — 60% всех миелом;
- диффузная — 24% всех миелом.
Иммунохимическая классификация основана на определении принадлежности сывороточных и мочевых парапротеинов к определенным классам Ig. Иммунохимиче ские варианты: G-миелома, А-миелома, D-миелома, Е-миелома, М-миелома, диклоновая миелома, болезнь легких цепей, несекретирующая миелома.
Форма миеломной болезни зависит от «агрессивности» процесса. Н. Е. Андреева (1998) на основании комплексного клинико-лабораторного обследования больных, включая определение содержания в крови креатинина, билирубина, кальция, лактатдегидрогеназы, аминотрансфераз, β2-микроглобулина, С-реактивного протеина, митотической активности опухоли по индексу метки тритий-тимидином, бромдезоксиуридином, предлагает выделять:
- «тлеющую» миеломную болезнь без признаков прогрессирования в течение многих месяцев (лет);
- медленно прогрессирующую;
- быстро прогрессирующую — «агрессивную», в том числе миелому, трансформировавшуюся в саркому или острый плазмобластный лейкоз.
Вниманию читателей нашего журнала мы хотим предложить интересный, на наш взгляд, случай заболевания множественной миеломой. Уникальность случая состоит в том, что пациентка, у которой было верифицировано обсуждаемое заболевание длительное время до факта установления диагноза миеломы страдала множественной коморбидной патологией, приковывавшей основное внимание врачей, да и самой пациентки, к проявлениям ведущего сердечно-сосудистого синдрома. Наличие сердечно-сосудистых проблем у лиц пожилого возраста может в определенной степени ассоциироваться с поражением системы крови, костно-мышечными симптомами, однако последние остаются «за фокусом» врачебных размышлений, редко принимаются решения о дополнительном обследовании белков крови, костной плотности. Поводом для диагностических изысканий у обсуждаемой пациентки явились два обыденных для возрастной патологии, но, тем не менее, интересных события: перелом шейки бедра при травматическом факторе незначительной выраженности и прогрессирующее снижение зрения. Также примечательным являлся тот факт, что длительное время наша пациентка не страдала никакой инфекционной патологией, что указывало на исключительно высокий иммунитет. Ретроспективные размышления по указанным данным привели к закономерному выводу, что все эти клинические особенности могли быть обусловлены прогрессированием гематологического заболевания — парапротеиноза с синдромами гипервязкости крови, костной деструкции, избытком секреции иммуноглобулина G.
Пациентка Р., 86 лет на момент рассмотрения по вышеуказанному поводу более 10 лет страдала ишемической болезнью сердца, атеросклерозом коронарных артерий, аорты, атеросклеротическим кардиосклерозом, с 2003 года осложненным прогрессирующей ХСН. У нее периодически возникали нарушения ритма сердца по типу наджелудочковой и желудочковой экстрасистолии, пароксизмов наджелудочковой тахикардии, пароксизмов фибрилляций предсердий (последний пароксизм от 15.06.06, купирован). В течение последних лет принимала следующие препараты: бета-адрено-блокаторы, ингибиторы ангиотензинпревращающего фермента, антиагреганты, статины. Так же были диагностированы многочисленные сопутствующие заболевания. Более 15 лет отмечала периодическое повышение АД до 180/100 при резкой перемене погоды, рабочим давлением считала уровни 120/80 мм рт ст. Атеросклероз сонных артерий: множественные стенозы ОСА, ВСА, НСА, цереброваскулярная болезнь, атеро склероз сосудов головного мозга, хроническая недостаточность мозгового кровообращения в вертебральнобазилярном бассейне диагностированы с 2003 года. С 2004 года установлена дисциркуляторная энцефалопатия 3-й ст., декомпенсация. В течение нескольких лет до описываемых событий наблюдалась также по поводу многоузлового узлового зоба 2-й степени, состояние эутиреоза. Из костно-суставной патологии отмечены остеоартроз правого коленного сустава II — III степени, дегенеративное изменение мениска правого коленного сустава.
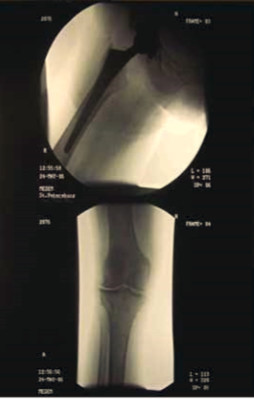
Одним из значимых медицинских событий в жизни пациентки с приведенным комплексом патологии явился случайный перелом шейки правой бедренной кости. По этому факту 26.02.2006 г. выполнена операция тотального эндопротезирования правого тазобедренного сустава (рис. 1).
Рис. 1. Рентгенограмма тазобедренного сустава после операции тотального эндопротезирования правого тазобедренного сустава от 26.02.2006 г.
Среди вариантов сопутствующей патологии обращали на себя внимание варикозная болезнь; хроническая венозная недостаточность — I степени, диагностированные с 2003 года.
Также за 2 года до описываемых событий, в 2005 году гематологом верифицирована анемия нормохромная, нормоцитарная, легкой степени, смешанного генеза: железодефицитная и В12-дефицитная.
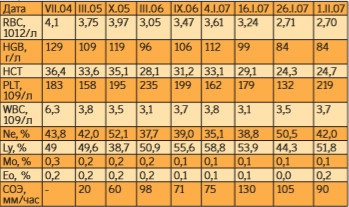
Во время последней госпитализации в январе 2007 года, проводившейся по поводу нарушений сердечного ритма, в анализе крови обратил на себя внимание анемический синдром (со сниженным количеством эритроцитов до 3,61×1012/л; с лейкопенией до 3,5×109/л; гемоглобином 112 г/л, относительным лимфоцитозом 58,8%, умеренной тромбоцитопенией — 162×109/л). Ретроспективное рассмотрение показателей клинического анализа крови выявило интересную динамику параметров эритроцитарного и лейкоцитарного рядов: постепенное снижение числа эритроцитов, лейкоцитов и скачкообразный рост количества лимфоцитов, значительное увеличение СОЭ (табл. 1).
Таблица 1. Ретроспективный анализ показателей клинического анализа крови пациентки
Учитывая анемический синдром, было проведено дополнительное обследование для исключения новообразования внутренних органов (анализ онкомаркеров, УЗИ внутренних органов). Также выявлены анамнестические сведения о консультации пациентки гематологом в апреле 2005 года: с учетом нормального содержания железа, фолиевой кислоты и витамина В12 в сыворотке крови, отсутствия данных за онкологическую патологию, положительного эффекта от проведенной общеукрепляющей терапии, нормальных показателей ферритина и железосвязывающей способности сыворотки крови было высказано предположение о возможном дефиците пластических элементов кроветворения в костном мозге и выставлен диагноз анемии смешанного генеза (В12 и железодефицитная) легкой степени; рекомендовано проведение терапии препаратами железа и витамина В12 в течение 1 месяца с целью восполнения костно-мозгового депо. Указанный вариант терапии не был эффективен. Позже проведен скрининг аутоиммунных заболеваний как вероятных причин анемического синдрома: каких-либо специфических антител к форменным элементам крови или их пластическим компонентам не было выявлено.
С учетом нарастающего анемического синдрома выполнено УЗИ и КТ органов брюшной полости: данных за увеличение и изменение структуры паренхиматозных органов живота не выявлено. В заключении по лучевым методам исследования значилось: признаки хронического атрофического панкреатита, хронического холецистита, кисты правой почки; признаки мелких кистозных образований матки; КТ — признаки грыжи пищеводного отверстия диафрагмы.
Пациентка вновь консультирована гематологом. При объективном исследовании кожа и видимые слизистые бледные, чистые. Признаков геморрагического синдрома нет. Периферические лимфатические узлы не увеличены. Гепато и спленомегалии нет. В гемограмме сохранялась трехростковая цитопения, нейтропения, относительный лимфоцитоз, определялась нормохромная, нормоцитарная анемия легкой степени. Ретроспективный анализ всех анамнестических данных, выписных справок, амбулаторно выполняемых исследований позволил отметить постепенное повышение общего белка (табл. 2).
Таблица 2. Динамика концентрации общего белка крови пациентки
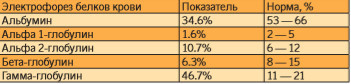
При дополнительном исследовании белков крови методом электрофореза выявлен М-градиент в гамма-спектре, альбумины были снижены до 32,6%, глобулины повышены до 67,4%, за счет гамма-глобулинов 46,7% (табл. 3).
Таблица 3. Фракции белка крови пациентки
На основании приведенных данных сделано предположение о наличии у пациентки дебюта одного из нижеуказанных заболеваний: парапротеинемического гемобластоза в варианте множественной миеломы, макроглобулинемии Вальденстрема, секретирующей лимфомы. Также проводился дифференциальный диагноз с группой моноклональных гаммапатий неутонченного первичного генеза.
С целью оценки костно-мозгового кроветворения под местной анестезией 1%-ным раствором лидокаина была выполнена аспирационная биопсия костного мозга из задней верхней ости левой подвздошной кости. Получен 1 мл костно-мозгового пунктата для цитогенетического и цитологического исследования. В миелограмме был выявлен плазмоцитоз костного мозга до 72,6%.
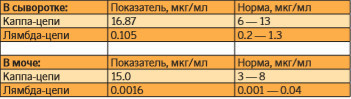
При дальнейшем обследовании: суточная потеря белка составила 387,3 (при норме до 141), концентрации Ig А и Ig М были снижены до 0,22 г/л (при норме не ниже 0,25 г/л) и до 0,33 г/л (при норме не ниже 0,4 г/л) соответственно, а уровень Ig G составил 48,74 г/л (при норме 7 — 16 г/л). В исследовании легких цепей Ig обнаружено увеличение числа каппацепей в сыворотке крови (до 16,87 мкг/мл) и в моче (до 15,0 мкг/мл) (табл. 4).
Таблица 4. Данные исследования легких цепей Ig
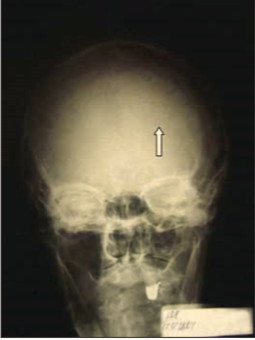
Выполнены также рентгенограммы плоских костей: черепа, костей таза, ребер. На рентгенограмме черепа вблизи венечного шва справа в лобной кости определяется округлый участок разрежения костной ткани с умеренно склерозированным контуром, более вероятно — пахионова грануляция, но нельзя исключить наличие солитарного миеломного очага (рис. 2).
Рис. 2. Рентгенограмма черепа, солитарный миеломный очаг (указан стрелкой)
C учетом плазмоцитоза костного мозга (72,6%), парапротеинемии, увеличения Ig G до 47 г/л, выявления легких цепей класса каппа, был выставлен окончательный диагноз: множественная миелома, диффузно-очаговая форма, III А стадия, тип G, класс каппа. Миеломная нефропатия ХПН-О. Рекомендовано назначение паллиативной химиотерапии с целью редукции опухолевой массы.
По данным консилиума гематологов, «диагноз множественной миеломы у больной не вызывает сомнения; он установлен на основании увеличения плазматических клеток в миелограмме до 72,6%, увеличения Ig G до 48,74 г/л, наличия моноклонового белка (увеличения легких цепей каппа в сыворотке 16,87 мкг/мл, в моче 15,0 мкг/мл), анемии (Hb 84 г/л), диффузного остеопороза плоских костей; учитывая отсутствие изменений в уровне b2-микроглобулина и нормальные показатели цитогенетического исследования можно говорить об отсутствии прогностиче ски неблагоприятных факторов…».
Ведущее значение в диагностике миеломной болезни имеют следующие основные диагностические критерии (Н. Е. Андреева, 1998): плазмоклеточная инфильтрация костного мозга; моноклональная Ig-патия (сывороточный М-градиент и/или белок Бенс-Джонса в моче, доказанные методами иммунохимического анализа сывороточных и мочевых иммуноглобулинов). Только сочетание этих двух признаков делает диагноз заболевания достоверным [4].
В большинстве случаев дифференциальный диагноз не представляет трудностей. Иммунохимические исследования с набором антисывороток против тяжелых и легких цепей иммуноглобулинов позволяют дифференцировать миеломную болезнь и макроглобулинемию Вальденстрема (наличие IgM), болезни тяжелых цепей, μ, γ, α (отсутствие легких цепей в молекуле иммуноглобулина).
Не всегда легко диагностировать несекретирующую миелому. Диагноз верифицируют с помощью иммунофенотипирования плазмоцитов костного мозга и реакции Coons (метод иммунофлюоресценции) [5].
Лечебная программа при миеломной болезни включает: цитостатическую терапию; локальную лучевую терапию; лечение α-интерфероном; лечение и профилактику осложнений, симптоматическую терапию; трансплантацию костного мозга [6].
По результатам клинического обследования и последующего наблюдения пациентке, обсуждаемой в нашей статье, верифицирован следующий диагноз:
Основное заболевание: множественная миелома, диффузно-очаговая форма, III А стадия, тип G, класс каппа.
Сопутствующая патология: ишемическая болезнь сердца: атеросклероз коронарных артерий, аорты, атеросклеротический кардиосклероз с НСР по типу ЖЭ, НЖЭ, пароксизмов наджелудочковой тахикардии, пароксизм фибрилляции предсердий от 15.06.2006, купирован самостоятельно. Пароксизм наджелудочковой тахикардии от 04.01.06 (купирован самостоятельно).
Гипертоническая болезнь 3-й стадии, артериальная гипертензия 3-й степени, риск сердечно-сосудистых осложнений 4, гипертонический криз от 04.01.07.
Атеросклероз сонных артерий: множественные стенозы сонных артерий (ОСА, ВСА, НСА). Цереброваскулярная болезнь. Атеросклероз сосудов головного мозга. Хроническая недостаточность мозгового кровообращения в вертебрально-базилярном бассейне 2 — 3 ст. Дисциркуляторная энцефалопатия 3-й степени, декомпенсация.
Дислипидемия 2а, корригируемая статинами.
Многоузловой зоб 2-й степени, эутиреоз.
Остеоартроз II — III ст. правого коленного сустава, genu valgus правой голени, дегенеративное изменение латерального мениска правого коленного сустава.
Операция тотального эндопротезирования правого тазобедренного сустава от 26.02.2006 г. при закрытом медиальном переломе шейки правой бедренной кости от 26.02.2006 г.
Плоскостопие I-II ст. Hallux valgus левой стопы. Костная деформация II пальца левой стопы.
Варикозная болезнь нижних конечностей, поверхностная, двусторонняя. Хроническая венозная недостаточность I ст.
Полная адентия нижней челюсти. Частичная адентия верхней челюсти.
OD: Атеросклеротическая центральная хориоретинальная дегенерация, неоваскулярная стадия, переход в рубцовую форму.
OS: Атеросклеротическая центральная хориоретинальная дегенерация экссудативная форма, состояние после фокальной лазеркоагуляции макулярной области.
OU: Гипертоническая ангиопатия сетчаток обоих глаз с ангиосклерозом. Начальная возрастная катаракта. Влажная форма склероти
ческой макулодистрофии, о/у 1а б/мед. глаукома псевдонормального давления.
Онихомикоз стоп. Межпальцевой микоз.
Себорейный кератоз.
Осложнения:
Миеломная нефропатия. ХПН-О.
Анемия нормохромная, нормоцитарная, тяжелой степени (гипорегенераторная на фоне нарушения созревания эритроцитов, вследствие плазмоклеточной метаплазии костного мозга). Вторичная нейтропения. Вторичное иммунодефицитное состояние.
Хроническая сердечная недостаточность, IIа стадия, III ФК.
Учитывая возраст пациентки, характер сопутствующей патологии, была рекомендована низкоинтенсивная стандартная химиотерапия первой линии по программе МП — мелфалан 9 мг/м2/сутки внутрь в течение 5 дней + преднизолон 0,5 мг/кг внутрь в течение 5 дней; каждые 4 недели. Определенный интерес вызывает предложенная сопроводительная терапия ассоциированных с проводимым лечением проявлений: аллопуринол 0,1 — 3 раза в сутки, гидратация 1л/м2/сутки (с целью ощелачивания мочи), зомета 4 мг в/в капельно раз в 4 недели, интраглобин 2 мл/кг 100 — 200 мл в/в капельно в течение 6 — 8 часов каждые 4 недели, гемокомпонентная терапия — переливание эритроцитарной массы при снижении Hb < 80 г/л. Первый курс лечения (и 10 — 15 дней после окончания химиотерапии) предложено провести в условиях стационара. После 4 курсов терапии спланирована оценка эффективности лечения для решения вопроса о дальнейшем ведении пациентки.
Литература
1. Справочник гематолога. A-Z/ Бэйн Б. Дж., Гупта Р.; Пер. с англ. Мосоловой Т. П.; Под ред. Рукавицына О. А. — М.: БИНОМ. Лаборатория знаний, 2004.-280 с., ил.
2. Руководство по гематологии: в 3 т. Т. 2. Под ред. Воробьева А. И. 3-е изд., перераб. и допол. М.: Ньюдиамед; 2003. — 280 с., ил.
3. Абдулкадыров К. М. Клиническая гематология: Справочник. — СПб: Питер, 2006. — 448 с. — (Серия «Спутник врача»).
4. Окороков А. Н. Диагностика болезней внутренних органов: Т. 4. Диагностика болезней системы крови: — М.: Мед. лит., 2001. — 512 с., ил.
5. Болезни системы крови ( Файнштейн Ф. Э., Козинец Г. И., Бахоамов С. М., Хохлова М. П.; Предисл. Гаврилова О. К.). — 2-е изд., перераб. и доп. — Т.: Медицина, 1987. — 671 с.: рис., табл.
6. Окороков А. Н. Лечение болезней внутренних органов: Т. 3, кн. 2. Лечение болезней сердца и сосудов. Лечение болезней системы крови: — М.: Мед. лит., 2001. — 480 с., ил.
Источник: Обрезан А.Г., Богданов А.Н., Стрельников А.А., Новицкий А.В., Максимов А.А., Печенская А.В. Миеломная болезнь: трудности диагностики // Медицина XXI век № 7 {8} 2007, с. 54-56.