В настоящее время, несмотря на достигнутые успехи в диагностике и лечении, хроническая сердечная недостаточность (ХСН) является одной из главных причин инвалидизации и смертности больных. Статистические данные свидетельствуют о неуклонности роста распространенности ХСН во всех странах мира, независимо от политической и экономической ситуации. В экономически развитых странах мира ХСН страдает 1–2% населения в (Лазебник Л.Б., Мареев В.Ю. 1999). По данным Framingham Heart Study, частота ХСН увеличивается с возрастом и составляет 3% пациентов в возрасте 45–64 лет, 6% — в возрасте 67–75 лет, 10% — старше 75 лет (Buchanan А., Stan R., 1997). Только в США насчитывается до 5 млн больных ХСН и ежегодно диагностируется до 700 тыс. новых случаев заболевания.
В странах Западной Европы распространенность ХСН составляет 2,9–3,9%. По данным эпидемиологического исследования Общества сердечно–сосудистой недостаточности, распространенность ХСН в России достигает 4–5 %, что соответствует 6–7 млн человек (Беленков Ю.Н. и соавт., 2002). По прогнозам ACTION HF (Advisory Council To Improve Outcomes Nationwide in Heart Failure, США), еще у 20 млн человек имеется бессимптомная дисфункция сердца, которая в течение нескольких лет может трансформироваться в ХСН. Низкая доля реваскуляризации в остром периоде инфаркта миокарда, ограниченное количество плановых операций реваскуляризации миокарда и коррекции клапанных пороков сердца, алкоголизация населения и низкая приверженность к лечению служат причинами увеличения числа больных с ХСН в России (Беленков Ю.М. 2000).
Таким образом, проблема хронической сердечной недостаточности является одной из важнейших проблем кардиологии и всегда требовала внимательного изучения и детального анализа.
История ХСН насчитывает многие тысячелетия. Так, косвенные свидетельства внимательного отношения врачей древности связаны с Гиппократом, который описал отеки конечностей и скопление жидкости в полостях, изменения характеристик деятельности сердца, что, очевидно, имело прямое отношение к симптоматологии сердечной недостаточности (СН). С помощью перкуторного метода исследования, предложенного Ауэнбруггером, обнаруживались скопление жидкости в грудной и брюшной полости, границы органов, значимо изменяющиеся при патологии сердца. Лаэннек в 1819 г. издал труд об аускультации, позволяющей врачам выслушивать различные звуковые феномены, в том числе появляющиеся при снижении сократительной способности сердца. С.П. Боткин в первом выпуске своих клинических лекций (1867) описал возможные причины ослабления сердечной деятельности, указывая при этом на феномен растяжения полостей сердца, одышку, водянку. Недостаточность сократительной функции сердца описал и J. Mackenzie в своем учебнике о болезнях сердца (1910): дана картина увеличенной пульсирующей печени, положительного и отрицательного венного пульса, указаны причины неспособности сердечной мышцы поддержать циркуляцию крови.
Большой вклад в развитие учения о ХСН внесли отечественные и зарубежные учёные в 20–30-е гг. XX столетия. Так, до настоящего времени в нашей стране признана классификация Н.Д. Стражеско, В.Х. Василенко и Г.Ф. Ланга, утверждённая на XII Всесоюзном съезде терапевтов в 1935 г. Как показали исследования Н.Д. Стражеско и его школы, недостаточность кровообращения характеризуется понижением минутного объёма циркуляции и прогрессирующим нарастанием нарушений тканевого метаболизма. Работами Н.Д. Стражеско была показана неправильность концепции Eppinger (1927), который считал, что у сердечного больного первично нарушаются обменные процессы на периферии, а затем в силу повышенной работы сердца, вторично, происходит утомление миокарда и функциональная его слабость с развитием в дальнейшем недостаточности кровообращения. Тщательные исследования врачей клиники Г.Ф. Ланга (1935) показали, что чем больше выражена недостаточность сердца, тем больше снижен минутный объём кровообращения (МОК).
Большое значение для изучения ХСН имело открытие закона Франка — Старлинга (1895 и 1914 гг., соответственно). Выдающийся кардиолог XX века A. Guyton описал механизмы регулирования МО сердца и их значение для сердечной недостаточности.
В начале XX века был разработан электрокардиографический метод, уточняющий патологию сердечной мышцы при развитии симптомов недостаточности кровообращения (НК). В это же время обнаружена способность наперстянки усиливать сократимость сердечных волокон, в лечении сердечной недостаточности стали применять фитопрепараты наперстянки и был начат активный поиск путей синтеза сердечных гликозидов.
Дальнейшие исследования проблемы ХСН были нацелены на уточнение механизмов ее развития в зависимости от причин, приводящих к заболеванию сердца. Зарубежные исследователи С.К. Friedbery (1956) и K. Hegglin (1952) впервые ввели понятие «недостаточности низкого объёма». По их гипотезе, при заболеваниях сердца (клапанного аппарата, миокарда, гипертонической болезни) длительное перенапряжение сердца вызывает падение сократительной функции миокарда, а компенсаторные процессы в этих случаях направлены прежде всего на увеличение минутной работы сердца. Эти же авторы ввели понятие «недостаточности большого объёма», когда ведущими факторами в развитии компенсаторных приспособлений становятся гипоксия и гипоксемия. Г.Ф. Ланг также подчёркивал значение гипоксии в развитии сердечной недостаточности. Эти данные соответствовали результатам, полученным на сердечно-лёгочном препарате, согласно которым признаком сердечной недостаточности является повышение потребления кислорода при пониженной работе (Starlig E.H., Fisher, 1927). Факт повышения систолического и минутного объёма сердца при тиреотоксикозе, анемии, эмфиземе лёгких хорошо доказан многими исследованиями (Wetal D., 1927).
Некоторые исследования механизмов развития сердечной недостаточности показали, что наибольшей степени выраженности одышка достигает при митральном стенозе в связи с ранним повышением давления в системе лёгочной артерии и прогрессирующим застоем в малом круге кровообращения (Китаев Р.М., 1932).
В 1952 г. A. Cournand при исследованиях методом катетеризации сердца показал, что при декомпенсированных пороках сердца развивается дилатация, увеличивается остаточный объём крови в соответствующих полостях сердца. При этом, повышение диастолического давления и объёма крови в полости желудочков сердца, являющееся одним из важнейших факторов, стимулирующих его деятельность (усиление сокращения при увеличении диастолического объёма — закон Франка — Старлинга, 1927), было расценено как компенсаторно-приспособительный механизм при сердечной недостаточности.
Исследования C.J. Wiggers (1952) также показали, что характер, продолжительность и величина сердечного выброса в известной степени зависят от пресистолического объёма желудочков. C.J. Wiggers также полагал, что большое значение в регуляции силы сердечных сокращений имеют «первичные факторы, изменяющие реактивность миокарда»; к ним относятся состояние коронарного кровотока, гуморальные агенты и нервные воздействия на мышцу сердца. В 50-е годы XX века установлено, что значительное повышение силы сердечных сокращений может быть вызвано влиянием открытого И.П. Павловым «усиливающего нерва сердца» в связи с его воздействием на метаболизм миокарда. М.Е.Райскина (1955) в исследованиях, проведённых с применением радиоактивных изотопов, обнаружила усиление интенсивности образования в сердце макроэргических фосфорных соединений — аденозинтрифосфорной кислоты и фосфокреатина — при раздражении «усиливающего нерва».
В 1959 г. W. Raab показал, что повышение адренергической стимуляции сердца способствует усилению его работы. Это приводит к развитию гипертрофии миокарда. В 1978 г. Ф.З. Меерсон (1978) выделил три последовательных стадии гипертрофии повреждённого сердца: аварийная, завершившейся гипертрофии, прогрессирующего кардиосклероза. В середине 50-х годов также доказано, что первоначальное падение систолического и минутного объёмов сердца ведёт к появлению нейрогормональных сдвигов. Как было показано Lenzi F. (1959) при падении минутного объёма весьма рано включается повышение активности коры надпочечников, в частности продукция альдостерона. Эти исследования легли в основу изучения нейрогормональных механизмов патогенеза хронической сердечной недостаточности, воздействие на которые являются основой современного медикаментозного лечения.
Огромное значение имеют экспериментальные и клинические работы 90-х годов E. Braunwald, R. Rashmer., B. Folkow. Открытия, сделанные в дальнейшем на молекулярном и клеточном уровне, показали, что при всём разнообразии форм недостаточности сократительной функции сердца в основе всегда лежит нарушение энергообеспечения, утилизации энергии в аппарате кардиомиоцитов и нарушения в системе ионного транспорта (Dhalla N,S., 1982, Gwathmey J.K. et al, 1987, Perceault C.L. et al, 1992).
80-е и 90-е г.г. знаменуются бурным прогрессом в развитии учения о патогенетических механизмах ХСН. Появляются новые данные о ремоделировании сердца. Сначала речь идет о структурных нарушениях преимущественно левого желудочка, позже появляются данные о структурных нарушениях всех камер сердца. Следующим этапом в учении о ХСН является признание единства структурного и функционального ремоделирования не только сердца, но и всей сердечно-сосудистой системы, согласно которому все звенья системы кровообращения, включая периферические артериальные и венозные разветвления претерпевают значительные изменения в строении и функциональной активности. В этот период открыто и доказано влияние целого ряда нейрогормональных систем (ренин-ангиотензин-альдостероновой, натрийуретических пептидов, эндотелина, эндотелий-релаксирующего фактора, простациклина, кининов, простагландинов) в патогенезе ХСН. Эти же разработки легли в основу поиска и синтеза новых лекарственных средств для коррекции нейрогормональных нарушений как патогенетической основы сердечной недостаточности.
Нельзя не упомянуть ведущие научные статьи и монографии отечественных авторов: Н.Н. Савицкого, Ф.З. Меерсона, Б.Е. Вотчала, В.Г. Кукеса, В.И. Капелько, Н.М. Мухарлямова, А.Ю. Кобленца, М.С. Кушаковского, В.Ю. Мареева, А.В. Виноградова, Б.А. Сидоренко, Я.Ю. Багрова и др.
История изучения ХСН неразрывно связана с развитием представлений о терапии недостаточности кровообращения и в ней можно выделить несколько этапов:
- до 50-х годов — преимущественное использование сердечных гликозидов;
- 50–60 гг. — начало использования мочегонных средств;
- 70-е гг. — при лечении хронической сердечной недостаточности начинают использовать периферические вазодилататоры;
- 80-е гг. — широкое внедрение ингибиторов АПФ; с этого же времени отмечено ограничение применения периферических вазодилататоров;
- 90-е гг. — начато использование β-блокаторов; появился новый взгляд на спиронолактон как на нейрогормональный модулятор; показано, что длительное применение малых доз спиронолактона в лечении ХСН вместе с ИАПФ положительно влияет на выживаемость больных и замедляет прогрессирование ХСН за счёт уменьшения фиброза и ремоделирования сердца;
Таким образом, проблема ХСН имеет длительную историю развития и изучения отдельных аспектов этиологии, патогенеза, представлений о клинике и лечении, что, несомненно, способствует целостному пониманию вопроса в настоящее время.
Современные воззрения на проблему ХСН существенным образом уточняют многие положения, разработанные нашими предшественниками.
Так, относительно понятий ХСН и НК сегодня необходимо различать термины «недостаточность кровообращения» и «сердечная недостаточность». Термин «недостаточность кровообращения» включает в себя помимо сердечной недостаточности нарушение регуляции сосудистого тонуса, объема циркулирующей крови (ОЦК), снижение уровня оксигемоглобина в крови, изменение его свойств и другие причины и таким образом является более широким, нежели «сердечная недостаточность». В соответствии с вышеизложенным положением недостаточность кровообращения подразделяется на острую (сердечную и сосудистую) и хроническую (сердечную и сосудистую). Термин «хроническая сердечная недостаточность» помимо миокардиальной недостаточности включает в себя сердечную недостаточность вследствие болезней перикарда, врожденных и приобретенных пороков сердца, опухолей, травм сердца, нарушений сердечного ритма и проводимости.
Несмотря на многовековую историю изучения ХСН, в настоящее время в медицинской литературе отсутствует единое общепринятое определение сердечной недостаточности. Существует несколько определений ХСН, данных в разные годы различными авторами. Согласно E. Braunwald, сердечная недостаточность — это патологическое состояние, при котором нарушение функции сердца приводит к неспособности его перекачивать кровь со скоростью, необходимой для удовлетворения метаболических потребностей организма, и/или это происходит лишь при повышенном давлении наполнения (левого и/или правого желудочка) (Braunwald E, Grossman W, 1992). В соответствии с Рекомендациями Американской ассоциации кардиологов (2001) сердечная недостаточность — это комплексный клинический синдром, возникающий в результате любого структурного или функционального заболевания сердца, что нарушает способность желудочков наполняться или изгонять кровь.
По нашему мнению, ХСН можно определить как комплексный клинический синдром множественной этиологии, обусловленный первичным снижением насосной (наполнение и/или изгнание) деятельности сердца и приводящий к сложным приспособительным и патологическим реакциям гемодинамических (изменения сердечного выброса и периферического сопротивления), нейрогормональных (дисбаланс СНС, РААС, эндотелин, вазопрессин, и EDRF, простациклин, брадикинин, натрийуретические пептиды) систем и к метаболическим нарушениям, что клинически выражается одышкой, сердцебиением, повышенной утомляемостью, ограничениеми физической активности и признаками задержки жидкости в организме.
На современном этапе существенно уточнены и классифицированы причины ХСН. Так, к развитию ХСН могут приводить, не только известные многим врачам ишемическая болезнь сердца, кардиомиопатии, миокардиты, артериальная гипертензия, но и редко воспринимаемые как причинные факторы ХСН нозологии: химические, токсические и лучевые повреждения миокарда (в том числе ятрогенные при медикаментозной и лучевой терапии); нарушения сердечного ритма и проводимости; системные заболевания соединительной ткани (системная красная волчанка, системная склеродермия, дерматомиозит, узелковый периартериит, системный эозинофильный васкулит, синдром Леффлера, саркоидоз); заболевания эндокринной системы (гипер- и гипотиреоз, феохромоцитома, болезнь Аддисона, болезнь и синдром Конна, заболевания гипофиза и гипоталамуса, сахарный диабет); заболевания крови (анемии; полицитемия); инфильтративные болезни сердца (амилоидоз, гемохроматоз, гликогеноз, мукополисахаридоз); миокардиальная недостаточность как компонент полиорганной недостаточности при декомпенсации заболеваний печени и почек.
По данным международного исследования Euro Heart Service Study, в котором принимала участие и Россия, среди всех перечисленных состояний, которые приводят к развитию ХСН, наиболее частыми являются: ИБС (60% всех случаев ХСН), клапанные пороки сердца (14%), дилатационная кардиомиопатия (11%). К удивлению, артериальная гипертензия (АГ) как основная причина предваряла развитие декомпенсации в 4 % случаев, хотя многие больные с ИБС имели повышенное артериальное давление (АД) (Беленков Ю.Н., Мареев В.Ю., 2001).
Помимо основных этиологических причин в настоящее время принято выделять дополнительные факторы, способствующие прогрессированию сердечной недостаточности: прекращение либо нерегулярный прием лекарств при лечении ХСН, гипертонической болезни (ГБ), ишемии и т.д.; простудные заболевания и/или обострение очагов хронической инфекции; увеличение массы тела; неблагоприятные условия внешней среды, метеозависимость; прием некоторых препаратов, вызывающих задержку в организме натрия и воды или оказывающих отрицательное инотропное действие — некоторые нестероидные противовоспалительные средства (ибупрофен, бутадион, индометацин, реопирин), гормональные препараты (эстрогены, андрогены, кортикостероиды); бета-блокаторы, антагонисты кальция, некоторые антиаритмические препараты (дизопирамид, новокаинамид, пропафенон, этацизин), некоторые трициклические антидепрессанты (амитриптилин), фенотиазиновые нейролептики (в частности аминазин), препараты лития, противоопухолевые средства (гидрохлорид фоксорубицина и рубомицина).
Из перечисленных факторов, приводящих к развитию ХСН, выделяют потенциально обратимые: воспалительные заболевания миокарда, пороки сердца (врожденные и приобретенные), перикардит (констриктивный и экссудативный), нарушения сердечного ритма (бради- и тахиаритмии), артериальная гипертензия, миксомы предсердий, анемия, тиреотоксикоз, микседема, ожирение, ишемическая болезнь сердца (ИБС) (в случае выполнения ангиопластики, аортокоронарного шунтирования, аневризмэктомии).
Существенное развитие на современном этапе получили патогенетические воззрения на ХСН. Прежде всего, это касается свойств сократимости и расслабляемости сердечной мышцы как ключевых в патогенезе ХСН. Так, в настоящее время принято различать клинические и патофизиологические понятия систолической и диастолической дисфункции. В патогенетическом аспекте систолической дисфункцией называют состояние, при котором снижается локальная или глобальная сократимость желудочков сердца, а сердечный выброс может поддерживаться с помощью компенсаторно-приспособительных интра- и экстракардиальных механизмов.
Диастолической дисфункцией (в патогенетическом понимании) называют невозможность левого желудочка принимать кровь под низким давлением и наполняться без компенсаторного повышения давления в левом предсердии и легочных венах. При этом расслабление желудочка замедлено отсрочено или происходит не полностью и развиваются признаки легочного или системного застоя (Жаринов О.И., Антоненко Л.Н.. 1995). В качестве клинического понятия систолическую дисфункцию («систолическая сердечная недостаточность») можно определить как симптомокомплекс признаков ХСН при нарушении систолической и сохранной или измененной диастолической функции левого желудочка, возникающий у больных со сниженной сократимостью миокарда. Клиническое представление о диастолической дисфункции («диастолическая сердечная недостаточность») заключается в наличии симптомокомплекса признаков недостаточности кровообращения при сохраненной систолической и нарушенной диастолической функции левого желудочка.
К настоящему времени также установлены и определены ведущие патогенетические процессы в сердечной мышце (некроз, апоптоз, дистрофия, гибернация, ишемическое прекондиционирование), приводящие к ХСН. Эти процессы охватывают не всю сердечную мышцу сразу, что обусловливает так называемую структурную и функциональную гетерогенность миокарда.
Достижением последних лет можно считать введение новых клинико-физиологических понятий при ХСН — функциональное и структурное ремоделирование сердца.
Под структурным ремоделированием сердца понимают изменение геометрии и размеров его полостей и миокарда. В соответствии с нашими клиническими исследованиями у больных с сердечно-сосудистой патологией, приводящей к развитию ХСН, определяются по крайней мере 5 различных типов геометрии левого желудочка: концентрическое ремоделирование, концентрическая гипертрофия, эксцентрическое ремоделирование, эксцентрическая гипертрофия и эуцентрическая гипертрофия. Важно отметить, что концентрические типы геометрии (концентрическое ремоделирование и концентрическая гипертрофия) сопровождаются исключительно диастолической сердечной недостаточностью, в то время как эксцентрическое ремоделирование определяет преимущественно систолический компонент сердечной недостаточности (диастолическая дисфункция также присутствует, но играет второстепенную роль в симптоматологии ХСН). Эксцентрическая и эуцентрическая гипертрофия чаще составляют основу комбинированной систолодиастолической сердечной недостаточности. Функциональное ремоделирование сердца объединяет такие процессы как изменение сократимости и расслабления желудочков и предсердий, асинхронность деятельности отдельных участков миокарда или камер сердца, нарушения сердечного ритма и проводимости.
Одним из новых представлений в патогенезе ХСН можно считать развитие теории диастолической сердечной недостаточности. Изучение данной проблемы позволило нам сформулировать перечень вероятных причин диастолической сердечной недостаточности у больных с сердечно-сосудистой патологией (Шевченко Ю.Л. и соавт., 2002):
1) правожелудочковая сердечная недостаточность (легочная гипертензия, кардиомиопатия правого желудочка; миксома правого предсердия; внутрисердечное шунтирование);
2) заболевания, протекающие с первичной гипертензией в левом предсердии (обструкция тракта притока в ЛЖ, обструкция легочных вен, синдром «жесткого левого предсердия», острая или хроническая перегрузка объемом, регургитации, шунты, хроническая почечная недостаточность, сердечная недостаточность с высоким выбросом); 3) заболевания, протекающие с диастолической дисфункцией ЛЖ (ишемическая болезнь сердца, артериальная гипертензия, ремоделирование и гипертрофия ЛЖ, обструкция тракта оттока из ЛЖ, гипертрофическая кардиомиопатия, рестриктивная кардиомиопатия, инфильтративные заболевания миокарда (амилоидоз, саркоидоз, гемохроматоз), болезни эндокарда и перикарда, миокардиодистрофии и интоксикации, нарушения автоматизма, проводимости и возбудимости миокарда, нарушения реологических свойств крови) и др.
По данным R.S. Vasan et al. (1996), около одной трети пациентов с недостаточностью кровообращения имеют преимущественно диастолическую дисфункцию.
Не менее впечатляющие результаты достигнуты в изучении нейрогуморальных звеньев патогенеза ХСН. Детально изучены такие гуморальные факторы как норадреналин, адреналин, ангиотензин-II (А-II), вазопрессин, эндотелиальные факторы релаксации (NO, эндотелиальный фактор гиперполяризации, простациклин, брадикинин) и констрикции (эндотелины-1, 2, 3; эндопероксид, тромбоксан-А2; супероксид-анион); опухолевый некротизирующий фактор (фактор некроза опухоли-α или ФНО-α/tumor-necrosis factor — TNF-α) и др. Так, например, повышение активности последнего, отмечаемое при выраженной сердечной недостаточности, может способствовать не только развитию кахексии (системное действие), но и прогрессированию дисфункции левого желудочка (на органном уровне).
Интересные сведения получены относительно каждой из ключевых нейрогуморальных систем. Так, изучены изменения адренергического рецепторного представительства в миокарде при ХСН: если в норме соотношение β1 и β2 рецепторов составляет приблизительно 80:20, то при ХСН представительство рецепторных полей значительно изменяется. Выявлено, что при ХСН снижаются плотность и чувствительность адренорецепторных полей миокарда. Именно таким охранительным образом организм реагирует на избыточную симпатическую стимуляцию, имеющую, в том числе, прямой кардиотоксический эффект. На начальных этапах ХСН наблюдается своеобразное регулирующее влияние СНС на сердечно-сосудистую систему и почки. При декомпенсации этой деятельности отмечаются: кардиотоксичность, увеличение работы сердца, вазоспазм — ухудшение периферического кровотока, «десенситизация» адренорецепторов кардиомиоцитов, стимуляция системы ренин-ангиотензин-альдостерон, стимуляция развития фиброза миокарда, усиление реабсорбции натрия и воды.
В отношении РААС сегодня принято выделять эффекты циркулирующей (хронотропное и аритмогенное действие; задержка натрия и воды, вазоконстрикция) и тканевой (ремоделирование сердца, почек, сосудов) РААС.
Концепция двухкомпонентности ренин-ангиотензинальдостероновой системы была сформирована в 80-е гг. в связи с прогрессом в области молекулярной и клеточной биологии. Обоснованием наличия тканевых (локальных) РААС послужило представление биохимических доказательств присутствия всех компонентов этой системы (ангиотензиноген, ренин, АПФ, А-II и ангиотензиновые рецепторы) в различных органах и тканях, включая сердце и почки. Именно тканевое содержание ренина и А-II является гораздо более важным в определении степени активности РААС, нежели их концентрация в плазме периферической крови. Современные воззрения на РААС учитывают также наличие нескольких подтипов рецепторов к А-II (АТ1, АТ2 и т.д.). Основными эффектами стимуляции АТ1-рецепторов к А-II являются: вазоконстрикция, стимуляция синтеза альдостерона, реабсорбция натрия, рост миокарда и пролиферация ГМК, повышение периферической НА активности, повышение активности центрального звена СНС, стимуляция освобождения вазопрессина, снижение ренального кровотока, блокада образования ренина. Активность АТ2-рецепторов характеризуется: стимуляцией апоптоза, антипролиферативным действием, ростом эндотелиальных клеток, активизацией регенерации клеток и тканей, вазодилатацией.
В последние годы большое внимание уделяется исследованию эффектов альдостерона при ХСН. Этот компонент РААС играет важную роль в патогенезе сердечной недостаточности. Основными описанными в последние годы физиологическими эффектами альдостерона, имеющими значение при ХСН, являются: 1) задержка натрия и жидкости (активизация почечных рецепторов к альдостерону); 2) активизация альдостеронзависимой коллагеназы (развитие фиброза миокарда, периваскулярного/интерстициального фиброза и прогрессирование морфологического и функционального ремоделирования сердца и сосудов, в том числе коронарных); 3) усиление экскреции калия и магния; 4) замедленное выведение норадреналина. Каждый из перечисленных механизмов приводит к своим патогенетическим последствиям: отеки и другие клинические признаки ХСН; систолическая и диастолическая дисфункция ЛЖ; повышение аритмогенности миокарда; периферическая вазоконстрикция и т.д.
По современным представлениям одну из ключевых ролей в патогенезе ХСН играет система натрийуретических пептидов, которая состоит из нескольких компонентов: предсердного натрийуретического пептида (ANF, или ПНУП); мозгового нартрийуретического пептида (BNF, или МНУП); эндотелиального нартрийуретического пептида (CNF, или ЭНУП) и дигиталисоподобного нартрийуретического фактора (ДНУП). Современные тенденции в диагностике ХСН предусматривают также определение концентрации ПНУП для определения степени тяжести сердечной недостаточности, а также для дифференциальной диагностики одышки легочного и сердечного происхождения.
В последние годы активно изучается функция эндотелия— главного для гемодинамики и самого большого эндокринного органа нашего организма. Наиболее значимые механизмы эндотелиальной дисфункции при ХСН можно охарактеризовать следующим образом: повышение активности СНС и РААС, сопряженное со стимуляцией определенных структур эндотелия и нарушение равновесия в синтезе EDRFs и EDCFs; увеличение экспрессии, синтеза и содержания в плазме эндотелинов (ЭТ-1, ЭТ-2, ЭТ-3), обладающих собственным вазоконстрикторным и пролиферативным действием; увеличение активности эндотелиального АПФ, сопровождающееся увеличением синтеза АII и ускорением распада (ослаблением влияния) брадикинина; инактивация/подавление экспрессии эндотелиальной NO-синтетазы и снижение синтеза NO и другие.
Одним из важнейших направлений современного изучения ХСН является исследование тканевых аспектов недостаточности кровообращения. Именно для ограничения и устранения тканевой гипоксии организм больного ХСН мобилизует компенсаторные и резервные механизмы нейрогормональной регуляции и гемодинамики.
При изучении проблемы сердечной недостаточности на современном этапе стал очевиден разрыв между экспериментальными и клиническими работами в кардиологии. Так, одним из противоречий современной кардиологии считается появление новых нозологических форм, являющихся по своей сути синдромами. Примером такой, новой для России, «синдромной нозологический формы» может служить хроническая сердечная недостаточность. Наличие глубоко научных многолетних представлений о недостаточности кровообращения как осложнении многочисленных патологических процессов в сердечно-сосудистой системе заставляет задуматься о целесообразности однобокого суждения по этой проблеме. Рассмотрение хронической сердечной недостаточности в качестве патологического процесса, происходящего исключительно вследствие несостоятельности функционирования элементов сердца, не позволяет принимать во внимание многочисленные факторы, несомненно, имеющие патогенетическое значение в развитии симптоматики. Одним из таких факторов, участвующим в патогенезе сердечной недостаточности, является периферическое кровообращение.
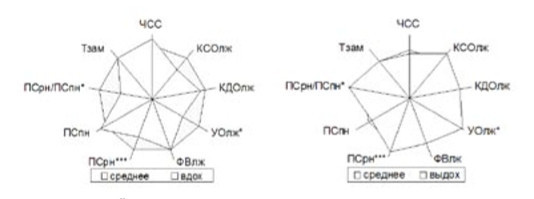
Работы по периферическому кровообращению и его значению в системной гемодинамике составляют важный этап кардиологической науки и практики, иллюстрирующий значимость системы кровообращения как целостно функционирующего элемента и традиционно проводились на кафедре пропедевтики внутренних болезней ВМедА. Периферический фактор кровообращения особенно тщательно изучен М.В. Яновским. Он и его сотрудники сформулировали гипотезу о наличии периферического активного гемодинамического фактора, способствующего системной циркуляции, — «периферического сердца». Нашими сотрудниками показано, что существенное изменение внутрисердечных объемов и скоростей внутрисердечного кровотока при колебаниях венозной составляющей гемодинамики позволяет сделать вывод о значительной роли венозных сосудов в системном кровообращении. Не менее значимое влияние оказывает на центральную гемодинамику и комплекс органов дыхания. На рис. 1 приведены данные, указывающие на значимость фаз вдоха и выдоха в центральной гемодинамике (Шевченко Ю.Л. и соавт., 2000).
Рис. 1. Изменения внутрисердечной гемодинамики на вдохе и выдохе.
Примечания: КСОЛЖ — конечный систолический объем ЛЖ; КДОЛЖ — конечный диастолический объем ЛЖ; УОЛЖ — ударный объем ЛЖ; ФВЛЖ — фракция выброса ЛЖ; ПСРН — пиковая скорость раннего наполнения ЛЖ; ПСПН — пиковая скорость позднего наполнения ЛЖ; ПСРН/ПСПН — соотношение пиковых скоростей раннего и позднего наполнения ЛЖ; Тзам — время замедления кровотока фазы раннего наполнения; * p<0,05; *** p<0,001.
И все же наиболее значимую позицию среди элементов периферического кровообращения, на наш взгляд, имеет артериальное русло. На существенное значение периферического звена кровообращения указывают многие авторы (Малая Л.Т. и соавт., 1994, Меерзон Ф.З., 1978, Обрезан А.Г. 1993, Кушаковский М.С., 1998). Наиболее интересными в контексте нашей статьи представляются данные В.Д. Ивановой и соавт. (2002) о том, что артерии обладают не только активными механическими, но и электрическими свойствами; пульсовая волна в артериальной системе представляет собой солитон, который распространяется от сердца на периферию, не угасая благодаря механизму предварительного активного расширения артерий, опережающего волну давления на 0,02–0,04 с в большом круге и на 0,06–0,12 с — в малом круге кровообращения.
Управляющим центром для такой активной перистальтической сосудистой волны, предваряющей сосудистый ударный объем, по мнению В.Д. Ивановой и соавт. (2002), может являться синусовый узел.
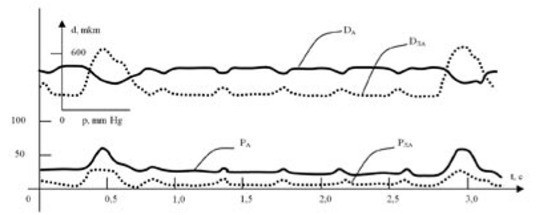
Еще одним свидетельством, приведенным теоретическим и эксперементальным положениям, служат данные о соответствии сократительно-дилататорной деятельности грудной аорты и легочной артерии и сокращений предсердий при поперечной блокаде сердца (Иванова В.Д. и соавт., 2002) (рис. 2).
Рис. 2. Сократительно-дилататорная деятельность грудной аорты (dA и РА) и легочной артерии (dЛА и PЛА), синхронная с сокращениями предсердий при поперечной блокаде сердца: диаметрально расположенные тензодатчики регистрируют синхронные о систолой предсердий сокращения грудной аорты и легочного ствола в период асистолии желудочков.
Наблюдения имеют не столько научное, сколько прикладное значение. В связи с вышеизложенными данными особое значение приобретает вопрос о целесообразности использования нового для России нозологического термина «сердечная недостаточность» вместо синдромального выражения «недостаточность кровообращения». Данные А.Г Обрезана и И.В. Вологдиной (2002) свидетельствуют о наличии симптомов сердечной недостаточности по NYHA 1 ФК у 44% и 2 ФК у 18% больных с фракцией выброса более 50%!. С другой стороны, отсутствие симптомов сердечной недостаточности встречается у больных с фракцией выброса особенностей формы, величины и продолжительности отдельных фаз внутрисосудистого кровотока у больных ХСН по сравнению с таковыми у больных без систолической дисфункции.
В подтверждение вышесказанному мы хотим привести наши статистические выкладки 2004 г. Проанализировав состояние внутрисердечной (объемные и скоростные характеристики внутрисердечного кровотока), центральной (морфометрические данные сердца, объемные и скоростные характеристики кровотока в аорте и легочной артерии) и периферической (морфометрия крупных артериальных сосудов, объемные и скоростные характеристики внутрисосудистого кровотока) гемодинамики на большом массиве больных (750 человек) с проявлениями сердечной недостаточности стадий «А», «В», «С», и «D» (АСС/АНА, 2002) мы пришли к заключению, что пациенты со стадией «В» (наличие ремоделирования сердца и отсутствие симптомов ХСН) и пациенты со стадией «С» (наличие симптомов ХСН при подлежащих патологии и ремоделировании сердечно-сосудистой системы) не имеют статистических различий между собой по показателям центральной гемодинамики, но достоверно различаются по отдельным показателям периферического кровотока (табл. 1).
Таблица 1. Сравнительная характеристика показателей центральной и периферической гемодинамики у больных кардиологическими заболеваниями с симптомами ХСН и без симптомов ХСН (M±σ).
Примечания: ФК ХСН — функциональный класс хронической сердечной недостаточности; КСРЛЖ, — конечный систолический размер левого желудочка; КДРЛЖ конечный диастолический размер левого желудочка; ФВЛЖ — фракция выброса левого желудочка; МОСА, — минутный объем кровотока через поперечное сечение сонных артерий; МОПА — минутный объем кровотока через поперечное сечение плечевых артерий; МОБА — минутный объем кровотока через поперечное сечение бедренных артерий.
| Показатели | Больные без симптомов ХСН | Больные с симптомами ХСН | p |
| Стадия ХСН по ACC/AHA | «В» | «С» | <0,01 |
| ФК ХСН (NYHA) | 0 | 1,37±0,57 | >0,05 |
| КСРЛЖ, см | 3,88±1,10 | 3,84±0,97 | >0,05 |
| КДРЛЖ, см | 5,47±0,91 | 5,42±0,79 | <0,05 |
| ФВЛЖ, % | 56,1±16,4 | 56,2±14,2 | >0,05 |
| МОСА, мл*мин–1 | 2,86±0,71 | 5,61±2,48 | <0,05 |
| МОПА, мл*мин–1 | 0,18±0,38 | 0,60±0,29 | <0,05 |
| МОБА, мл*мин–1 | 1,50±0,88 | 2,99±1,32 | >0,05 |
Полученные результаты свидетельствуют о том, что факт появления симптома ХСН может не зависеть от состояния сердца и более вероятно определяется условиями периферического кровообращения.
Необходимо отметить, что не только состояние периферического звена системной гемодинамики может определять симптоматологию ХСН. В подтверждение этого положения можно привести наши данные по сравнительной характеристике показателей центральной и периферической гемодинамики у больных с симптомами ХСН (стадия С АСС/АНА) и без субъективных или объективных проявлений ХСН (стадия В АСС/АНА). Следует подчеркнуть, что все больные, включенные в математический анализ, имели низкую фракцию выброса (табл. 2).
Таблица 2. Сравнительная характеристика показателей центральной и периферической гемодинамики у больных кардиологическими заболеваниями с симптомами ХСН и без симптомов ХСН (M±σ).
Примечания: ФК ХСН — функциональный класс хронической сердечной недостаточности; КСРЛЖ — конечный систолический размер левого желудочка; КДРЛЖ конечный диастолический размер левого желудочка; ФВЛЖ — фракция выброса левого желудочка; МОСА — минутный объем кровотока через поперечное сечение сонных артерий; МОПА — минутный объем кровотока через поперечное сечение плечевых артерий; МОБА — минутный объем кровотока через поперечное сечение бедренных артерий.
| Показатели | Больные симптомов ХСН | Больные с симптомами ХСН | p |
| Стадия ХСН по ACC/AHA | B | C | |
| ФК ХСН (NYHA) | 0 | 1,57±0,39 | <0,01 |
| КСРЛЖ, см | 4,90±1,21 | 4,81±1,07 | >0,05 |
| КДРЛЖ, см | 6,09±0,42 | 5,98±0,48 | >0,05 |
| ФВЛЖ, % | 38,2±8,8 | 39,2±9,2 | >0,05 |
| МОСА, мл*мин–1 | 1,55±0,31 | 1,67±0,58 | >0,05 |
| МОПА, мл*мин– | 0,02±0,04 | 0,16±0,09 | >0,05 |
| МОБА, мл*мин–1 | 0,78±0,58 | 1,05±0,92 | >0,05 |
Полученные результаты подтверждают наше предположение, что существенно измененные условия центральной и периферической гемодинамики могут быть компенсированы на тканевом уровне. По нашему мнению, вероятными факторами, участвующими в формировании субъективных или объективных проявлений ХСН могут быть: пороговые особенности восприятия нарушений гемодинамики, уровень микроциркуляции, функция вегетативной нервной системы, характер тканевого метаболизма, клеточной регенерации и репарации.
Одним из достижений медицинской науки последних лет является разработка молекулярных основ дисфункции кардиомиоцитов. В настоящее время существуют три основные гипотезы, объясняющие молекулярные основы ухудшения сократительной способности миокарда (Gwathmey J.K, Ingwall J.S, 1995). Первая указывает на нарушения баланса между энергообеспечением и энергозатратами при сокращении кардиомиоцита, что имеет ведущее значение на поздних этапах развития ХСН. Вторая гипотеза предполагает нарушение сопряжения процессов возбуждения и сокращения в миокарде (из-за повышения концентрации внутриклеточного кальция во время диастолы и/или ухудшения высвобождения кальция из эндоплазматического ретикулума во время систолы. Третьим вероятным молекулярным механизмом дисфункции кардиомиоцитов может быть сниженная чувствительность миофиламентов к кальцию.
В последние годы развитие клеточной и молекулярной биологии способствовало более глубокому проникновению в сущность процессов трофики миокарда при ХСН. Произошел переход от системно-органного к клеточному, молекулярному и даже генетическому уровням исследований проблем сердечной недостаточности. Эти исследования показывают, что механизмы сердечной дисфункции включают структурное и функциональное ремоделирование не только всех отделов сердечно-сосудистой системы (сердца, артерий, вен), но и всех тканевых и клеточных уровней и элементов (кардиомиоцитов, гладкомышечных клеток, эндотелия, внеклеточного матрикса, мембранных белков, внутриклеточных органелл, системы мессенджеров и т.д.)! Перечисленные процессы регулируются как путем активации нейроэндокринных систем организма, так и местными, локальными механизмами.
Генетические аспекты ХСН также активно изучаются сотрудниками кафедры пропедевтики внутренних болезней. Так, за последние годы получены впечатляющие результаты по участию отдельных генетических маркеров (кальциевая АТФ-аза, β1-адренорецепторы, инсулиноподобный фактор роста, фосфоламбан) в патогенезе ХСН (табл. 3).
Таблица 3. Характеристики основных генетических маркеров при ХСН.
| Наименование | Обозначение гена и его локус | Полиморфизм | Структура олигопраймеров |
| Са АТФ-аза СПР 2 типа (Аизоформа) | ATP2A212q23-q24.1 | Замена G/А в 54 положении 10 интрона гена | F: 5’- TTTGAAGGCGTGGATTGTGC -3’ R: 5’- TTGGGAAGGGAAGAACTGTC -3’ |
| В1-адренорецептор | ADRB110q24-q26 | Замена С/G в 1165 позиции, (Аrg389Gly в белке) | ADRB1: 5’- TGGGCTACGCCAACTCGG ADRB2: 3’- GGCCCCGACGACATCGTC |
| Инсулиноподобный фактор роста 1 типа | IGF112q22-q23 | CA-повторы в промоторной области | F: 5’- AGACTCCCTCTGTCATACAC -3’ R: 5’- TACCCTTCTCCCAGAGTGGT-3’ |
| Фосфоламбан | PLN 6q22.1 | Замена T / G в 11680 позиции | FL 1: GAGGTGAATATAATTTATATTACAATC FL 2: TT ACTTTTCCAACTTGATTCTCA |
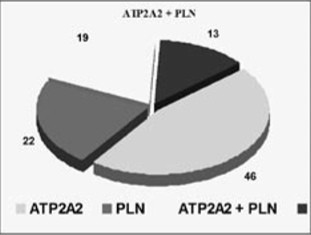
Рис. 3. Влияние полиморфизма генов ATP2A2 (кальциевая АТФ-аза), PLN (фосфоламбан), ADRB1 (бета-1-адренорецепторы), IGF1 (инсулиноподобный фактор роста) на дисперсию признаков, характеризующих эффективность лечения ХСН.
Наиболее эффективной терапия у пациентов с ХСН была в случае GG полиморфизма гена ATP2A2 (кальциевая АТФ-аза), GG полиморфизма гена PLN (фосфоламбан), Arg/Gly полиморфизма гена ADRB1 (бета-1-адренорецепторов) и 19/21 полиморфизма гена IGF1 (инсулиноподобный фактор роста). Особо следует отметить центральное место полиморфизма гена кальциевой АТФазы (индивидуальное и в сочетании с полиморфизмом гена фосфоламбана) в детерминации эффективности КТ у пациентов с ХСН, что, по-видимому, определяется ролью энергетического метаболизма и регуляции кальциевого трансмембранного тока в развитии и прогрессировании сердечной недостаточности.
Современный этап изучения ХСН также отмечен введением новых классификационных подходов к этой нозологии. В России в 2002 г. принята новая рабочая классификация ХСН, объединяющая классификации НК по Г.Ф. Лангу и СН по NYHA (табл. 4).
Таблица 4. Классификация хронической сердечной недостаточности (Общество сердечно-сосудистой недостаточности, 2002).
| Стадия ХСН (могут ухудшаться, несмотря на лечение) | Функциональные классы ХСН (могут изменяться на фоне лечения как в одну, так и в другую сторону) |
| I ст. Начальная стадия — заболевания (поражения) сердца. Гемодинамика не нарушена. Скрытая сердечная недостаточность. Бессимптомная дисфункция ЛЖ | I ФК Ограничение физической активности отсутствует. Привычная физическая активность не сопровождается быстрой утомляемостью, появлением одышки или сердцебиения. Повышенную нагрузку больной переносит, но она может сопровождаться одышкой и/или замедленным восстановлением сил. |
| II А ст. Клинически выраженная стадия поражения сердца. Нарушения гемодинамики в одном из кругов кровообращения выраженные умеренно. Адаптивное ремоделирование сердца и сосудов. | II ФК Незначительные ограничения физической активности. В покое симптомы отсутствуют. Привычная физическая активность сопровождается утомляемостью, одышкой или сердцебиением. |
| II Б ст. Тяжёлая стадия поражения сердца. Выраженные изменения гемодинамики в обоих кругах кровообращения. Дезадаптивное ремоделирование сердца и сосудов. | III ФК Заметное ограничение физической активности. В покое симптомы отсутствуют, физическая активность меньшей интенсивности по сравнению с привычными нагрузками сопровождается появлением симптомов. |
| III ст. Конечная стадия поражения сердца. Выраженные изменения гемодинамики и тяжёлые (необратимые) структурные изменения органов-мишеней (сердце, лёгкие, сосуды, головной мозг, почки). Финальная стадия ремоделирования органов. | IV ФК Невозможность выполнить какую-либо физическую нагрузку без появления дискомфорта; симптомы СН имеются в покое и усиливаются при минимальной физической активности. |
Таблица 5. Параметры физической активности и потребления кислорода у больных с различными ФК ХСН (NYHA).
| ФК | Дистанция 6минутной ходьбы, м | Потребление кислорода, мл/ мин/м2 |
| 0 | ≥551 | ≥22,1 |
| I | 426–550 | 18,1–22,0 |
| II | 301–425 | 14,1–18,0 |
| III | 151–300 | 10,1–14,0 |
| IV | ≤150 | ≤10,0 |
В настоящее время с появлением современных инструментальных методов многие практические врачи недооценивают значимость изучения данных объективного исследования у больных ХСН. В то же время тщательный сбор анамнеза и объективное обследование пациента позволяет не только получить много полезной диагностической информации, но и правильно интерпретировать результаты инструментальных методов исследования. Примером может служить диссоциация выраженности клинического проявления ХСН у больных с диастолической дисфункцией левого желудочка.
В историческом плане клиническая картина ХСН также претерпела определенные изменения. Так, если в XVIII–XIX вв. основными субъективными проявлениями ХСН были отеки, то, в последние десятилетия наиболее типичными жалобами при ХСН считаются одышка и утомляемость. Наиболее типичными объективными симптомами ХСН являются диастолический ритм галопа, влажные «застойные» хрипы в легких, набухание шейных вен и отеки ног. При прогрессировании недостаточности кровообращения по обоим кругам развиваются постоянные отеки, анасарка, асцит, гидроторакс, гидроперикард, кардиальный фиброз печени, дистрофическое изменение тканей и органов. Описаны также отличительные особенности симптомокомплекса, наблюдаемого у пациентов с преимущественно диастолической сердечной недостаточностью: пожилой возраст больных, преимущественно женский пол, наличие избытка массы тела, длительное течение АГ, наличие сахарного диабета или других болезней, вызывающих инфильтративное поражение миокарда и преимущественное поражение правых отделов сердца. Особенностью современной клинической картины ХСН можно также считать большой процент малосимптомных и бессимптомных форм заболевания.
Среди инструментальных диагностических методов также отмечен существенный прогресс. Так, эхокардиография (ЭхоКГ) рассматривается как один из наиболее информативных методов верификации сердечной патологи при ХСН. Новейшие достижения эхокардиографии позволяют врачу оценивать не только глобальную, но и регионарную диастолическую функцию ЛЖ, нарушения которой рассматриваются как наиболее ранние и чувствительные показатели нарушений не только функции расслабления миокарда, но и его сократимости. Нагрузочная или фармакологическая стрессэхокардиография позволяет выявить ишемию как возможную причину обратимой или длительно существующей дисфункции миокарда и оценить жизнеспособность миокарда в зонах акинезии.
Дополнительное, но все более весомое значение приобретают такие методы как сцинтиграфия миокарда с 201TI, компьютерная томография, позитронно-эмиссионная томография (выявление зон с нарушенной сократимостью, нарушенной перфузией и измененным метаболизмом), гнитно-резонансная томография и разновидность МРТ — магнитно-резонансная спектроскопия (позволяет количественно оценить биохимические характеристики миокарда, его энергетику, что имеет большое значение при проведении научных исследований).
Лабораторная диагностика ХСН до недавнего времени не имела широкого практического применения. Тем не менее, многие врачи используют лабораторную оценку содержания калия и натрия в крови для коррекции электролитного баланса у пациентов, принимающих диуретики, а также для контроля степени калиемии при терапии современными схемами, включающими верошпирон, ингибиторы АПФ и препараты калия. Определение нейрогормонов при ХСН имеет определенную перспективу. Вследствие того, что при сердечной недостаточности происходит активация симпатической нервной, ренин-ангиотензин-альдостероновой систем и системы натрийуретических пептидов, определение этих гормонов используют для оценки наличия сердечной недостаточности и ее тяжести. В лечении пациентов с ХСН также произошел определенный прогресс: модифицированы цели и принципы терапии, которые могут быть представлены следующим образом.
- Увеличение продолжительности жизни, снижение риска смертности.
- Максимально возможная модуляция гормональных и нейрогормональных систем. Предотвращение дальнейшего сердечно-сосудистого ремоделирования, и, по возможности, его обратное развитие.
- Снижение темпов прогрессирования/декомпенсации сердечно-сосудистых (ИБС, КМП, пороки сердца, ГБ, и др.) и других (сахарный диабет, болезни щитовидной железы, и др.)
- Повышение сократительной способности и сократительного синхронизма миокарда.
- Повышение качества жизни пациентов.
Большое значение в последние годы придается обучению больных с ХСН. Совершенствование обучения больного и наблюдение за ним после выписки способствуют уменьшению летальности и инвалидизации при сердечной недостаточности. Модификация образа жизни пациентом может улучшить качество жизни и даже исход заболевания. Зарубежная кардиология, в этом смысле продвинулась далеко вперед. Так, практически все современные руководства по курации пациентов кардиологического профиля содержат большие главы и обширные сведения по обучению больных.
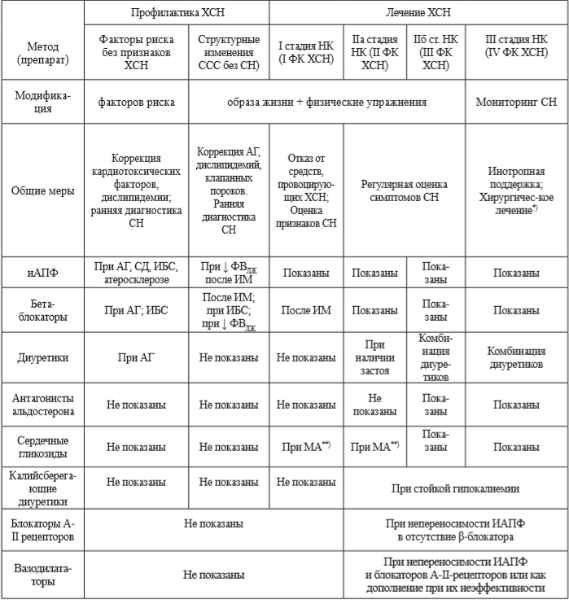
Основываясь на личном опыте, анализе многочисленных отечественных и зарубежных литературных источников мы предлагаем следующий итоговый вариант рекомендаций по терапии ХСН (табл. 6).
Таблица 6. Итоговые рекомендации по лечению ХСН (авторский вариант, 2002 г.).
Предлагаемые нами рекомендации содержат сведения о терапии ХСН как профилактической, так и лечебной направленности. Надеемся, что приведенные данные будут удобны для практического использования, полезны для врачей и позволят адекватно, на современном уровне лечить ХСН или предупреждать ее развитие.
Таким образом, на современном этапе проблема ХСН получила свое закономерное развитие в плане понимания основных этиопатогенетических процессов модификации клинической картины и применения новейших методов диагностики и лечения. Многое в данной проблеме остается спорным и неясным, что придает определенный оптимизм в планировании новых исследований в данной области.
Литература:
1. Беленков Ю.Н., Мареев В.Ю. Сердечно-сосудистый континуум // Сердечная недостаточность. – 2002. – Т.3, №1 (11). – С. 7–12.
2. Иванова В.Д., Пирогов В.П., Кошев В. И. Петров Е.С. Волобуев А.Н. Гемодинамическая функция сосудистого русла в норме и эксперименте // Системная гемодинамика и микроциркуляция, Куйбышев, КМИ. –1983. – С. 3 – 23.
3. Иванова В.Д., Кошев В.И., Пирогов ВЛ., Петров Е.С., Волобуев А.Н., Юнусов P.P. Гемодинамическая функция сосудистого русла в норме и эксперименте. – 2002. – 10 с.
4. Коновалов Е.Г., Кан Д.Л. ДАН БССР // Цит. по Аринчин Н.И. Внутримышечное периферическое сердце. – Минск. – 1974.– 150 с.
5. Куршаков Н.А. О периферическом артериальном сердце // Тер. Архив. – 1923. – Т.1. – С. 20.
6. Куршаков Н.А., Прессман Л.П. М.В. Яновский. К столетию со дня рождения (1854–1954). – Москва, 1954. – 60 с.
7. Кушаковский М.С. Хроническая застойная сердечная недостаточность. Идиопатические кардиомиопатии. СПб.: Фолиант. – 1998. – 320 с.
8. Лазебник Л.Б., Кузнецов О.О. Метопролол (корвитол 50R) как средство лечения ишемической болезни сердца на фоне артериальной гипертензии и сердечной недостаточности // Клин. Геронтология. – 1997. – № 4. – С. 4–8.
9. Малая Л.Т., Горб Ю.Г., Рачинский ИД. Хроническая недостаточность кровообращения. — К.: Здоров’я, 1994. — 624 с.
10. Мареев В.Ю. Рекомендации по рациональному лечению больных с сердечной недостаточностью // Сonsilium medicum. – 1999. – Т.1, №3. – С.109–147.
11. Меерсон Ф.З. Адаптация, дезадаптация и недостаточность сердца. М.: Медицина, 1978. – 20 с.
12. Обрезан А.Г., Яровицкая В.Н. Влияние гемодинамических изменений в системе полых вен на внутрисердечную и висцеральную гемодинамику // С. 243–264. – глава VIII в монографии Стойко Ю.М., Лыткин М.Н., Шайдаков Е.В. Венозная гипертензия в системе полых вен. – СПб.: ФГУП ЦКБ МТ «Рубин». – 2002. – 276 с.
13. Обрезан А.Г., Вологдина И.В. Хроническая сердечная недостаточность. – СПб.: «Вита Нова». – 2002. – 320 с.
14. Шевченко Ю.Л., Бобров Л.Л., Обрезан А.Г. Диастолическая функция левого желудочка сердца. – М.: ГЭОТАР–МЕД.– 2002. – 240 с.
15. ACC/AHA/ Guidelines for the Management of Patients With Chronic Heart Failure // internet source: www. acc.org.
16. Braunwald E. Heart disease: a textbook of cardiovascular medicine / Ed. E.Braunwald. – 4th ed. – Philadelphia.: Sounders. – 1992. – 1874, Xl.IV p.
17. Dhalla N.S., Pierce G.N., Panagia V., Singal P.K., Beamish R.E. Calcium movement in relation to heart function // Basic. Res. Cardiol. – 1982. – Vol.77. – P. 117–139
18. Gwathmey J.K., Copelas L., MacKinon K., Schoen F.J., Feldman M.D., Grossman W., Morgan J.P. Abnormal intracellular calcium handling in myocardium from patients with end-stage heart failure // Cir. Res. – 1987. – Vol.61, №1. – P. 70–76.
19. Perreault C.L., Shannon R.P., Komamura K. et al. Abnormalities in intracellular calcium regulation and contractile function in myocardium from dogs with pacing-induced heart failure // J. of Clinical Investigations. – 1992. – Vol.89. №3. – P. 932–939.
20. Tishakov AIu, Kovlen DV, Obrezan AG, Ponomarenko GN. [Combined use of natural physical factors in patients with chronic cardiac insufficiency at a balneological resort Vopr Kurortol Fizioter Lech Fiz Kult. 2005 Jan–Feb;(1):9–13.
Источник: Обрезан А.Г., Раймуев К.В. Хроническая сердечная недотаточность: состояние проблемф на современном этапе // Журнал "Вестник Санкт-Петербургской медицинской академии последипломного образования", с. 5-17