Эмболизация и функциональное значение афферентных сосудов
В. Б. Семенютин, П. И. Никитин, В. А. Алиев, И. М. Бухаев, Г. К. Панунцев
Для интраоперационного мониторинга внутричерепной гемодинамики необходимо использовать методический комплекс, включающий в себя непрерывную регистрацию линейной скорости кровотока методом транскраниальной доплерографии (MultiDopX, Germany), системного артериального давления инвазивно через катетер, установленный в бедренную артерию, или неинвазивно с помощью чрескожной фотоплетизмографии (Finometer, USA, CNAP, Austria) и давления крови в афферентном сосуде c помощью катетера (Balt, France) для проведения эмболизации.
На рис. 9.4 представлена динамика ЛСК, ДК в афферентном сосуде (СМА), САД и соответствуюшие им ангиограммы при проведении суперселективной эмболизации компартмента АВМ. Эмболизация сопровождается постепенным снижением ЛСК, повышением индекса пульсации и ДК в афферентном сосуде.
Для предупреждения развития неврологических осложнений и инвалидизации больных при эмболизации АВМ «функционально значимых» зон головного мозга предложены различные способы интраоперационного выявления последних. Так, широко известен способ определения функционального значения афферентного сосуда АВМ головного мозга путем временной его окклюзии баллоном и последующей оценки неврологической симптоматики (Хилько В. А., Зубков Ю. Н., 1982). К недостаткам способа можно отнести техническую сложность его выполнения и возможность травмирования сосуда. Кроме того, заранее неизвестна степень коллатерального кровообращения в бассейне афферентного сосуда при его проксимальной окклюзии, поэтому количество ложноотрицательных результатов теста может быть весьма существенным. Однако, по мнению A. Luessenhop и L. Rosa (1984), при расположении АВМ в речевых зонах все-таки решающим тестом служит изменение неврологических данных после временной окклюзии афферентного сосуда баллоном.
Наряду с этим был предложен интраоперационный способ определения функционального значения афферентного сосуда АВМ головного мозга с помощью модифицированного теста Wada (введение натрия амобарбитала во внутреннюю сонную артерию для определения речевой функции в доминантном полушарии было впервые предложено J. Wada, T. Rassmussen в 1960 г.). Через микрокатетер, установленный в афферентном сосуде АВМ, производили введение раствора барбитуратов короткого действия (25–75 мг амобарбитала (Amytal) или 3–10 мг метогекситала (Brevital)). Кратковременное развитие очаговой неврологической симптоматики указывало на функциональное значение этого сосуда (Лысачев А. Г., 1989; Berenstein A. et al., 1992; Rauch R. et al., 1992; Gross D., 1993; Peters K. et al., 1993).
К недостаткам фармакологических тестов можно отнести необходимость внутрисосудистого введения щелочного химического вещества, недостаточную точность способа из-за возможности инфузии препарата в сосуды головного мозга небольшого диаметра (1–1,5 мм), не участвующих в кровоснабжении АВМ, ограничения для использования в условиях проведения общей анестезии у детей.
Кроме того, по данным различных авторов, ложнонегативные ответы модифицированного теста Wada достигают 10% (Свистов Д. В., 1993; Rauch R. et al., 1992). Процент таких ложнонегативных ответов зависит от выраженности шунтирования крови, скорости введения и концентрации препарата.
Для снижения количества ложноотрицательных ответов наряду с клинической оценкой состояния пациентов во время проведения теста используют электроэнцефалографию (Connors J., Wojak J., 1999), соматосенсорные вызванные потенциалы при оценке функционального значения афферентного сосуда, возможно, кровоснабжающего глубинные структуры головного мозга (Kato Y. et al., 1998). Однако, несмотря на использование различных нейрофизиологических методик для этой цели процент ложнонегативных ответов, хотя он и несколько снижался в отдельных группах больных, в целом оставался достаточно высоким (Connors J., Wojak J., 1999).
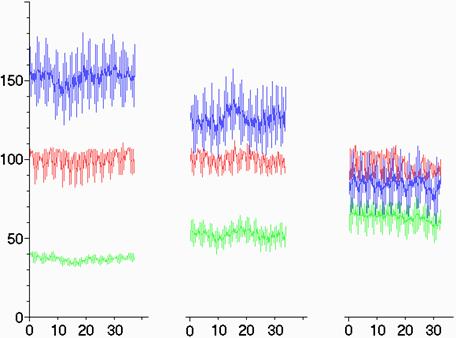
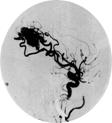

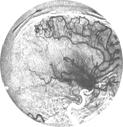
Рис. 9.4. Сверху вниз: динамика ЛСК (см/с), САД и ДК (мм рт. ст.) во время суперселективной эмболизации АВМ и соответствующие им каротидные ангиограммы (стрелкой указан компартмент АВМ, кровоснабжаемый СМА). Регистрация ЛСК и ДК в М1 СМА, САД в бедренной артерии. По оси абсцисс — время в секундах. А — до операции, Б — после субтотальной эмболизации, В — после полного выключения АВМ из бассейна СМА
Таким образом, отсутствие адекватных способов оценки функционального значения афферентных сосудов заставляет искать новые подходы для решения данной проблемы, к которым можно отнести моделирование, позволяющее определить расчетные величины показателей гемодинамики головного мозга и АВМ.
Математическое моделирование церебральной гемодинамики позволяет рассматривать модель как построение, имеющее некоторую функциональную эквивалентность реальной системе. В ней представлены гипотетические неотъемлемые свойства подлинной системы и не учитываются второстепенные факторы, которые считаются либо не имеющими отношения к делу, либо способными вводить в заблуждение. Модели облегчают понимание взаимосвязей между причиной и следствием в сложном физиологическом или патологическом процессе. Их самая сильная сторона — гибкость, которая недостижима при работе с интактной системой, а самая слабая — крайняя зависимость от допущений, принятых при построении, которая существует, несмотря на все используемые дедуктивные методы. При попытке создания модели физиологического процесса следует всегда помнить о чрезвычайной важности этих двух соображений. Результаты моделирования не следует напрямую экстраполировать на клиническую деятельность; скорее, их нужно использовать как рамки, в пределах которых можно лучше понять клинические симптомы. Модели полезны при разработке гипотез, которые проверяются путем проведения экспериментов.
Было предпринято несколько попыток моделирования АВМ на основании как физических, так и математических моделей (Lo E. et al., 1991; Nagasawa S. et al., 1993; Ornstein E. et al., 1994; Hademenos G. et al. 1996; Gao E. et al., 1997).
Целью математической модели мозгового кровообращения, построенной Е. Gao с соавт. (1997), было изучение влияния кровотока в артериовенозном шунте на нормальное сосудистое русло (рис. 9.5).
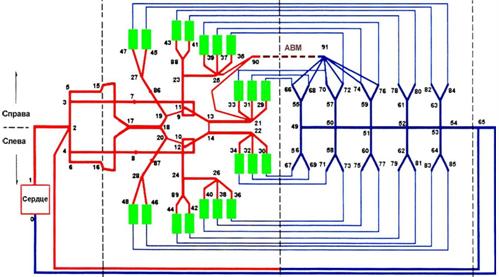
Рис. 9.5. Схематичное изображение модели сосудистой сети мозга. Более толстой линией обведен компартмент, содержащий идентичные сосуды, которые параллельны друг другу. Цифрами обозначены узлы. Между артериями и венами расположены 20 групп микрососудов, число которых в каждой из них равно 5000. Более тонкая линия, идущая между группой сосудов и веной, является не границей компартмента, а отражением связи между двумя из них. Отображена также АВМ средней мозговой артерии. Она объединяет узлы 90 и 91. Данная патология использовалась в нескольких имитационных моделях (Gao E. et al., 1997)
Эта модель тщательно сравнивалась с опубликованными ранее результатами экспериментальных исследований нормальных циркуляторных показателей и изменениями давления, обусловленными высоким кровотоком через артериовенозный шунт (рис. 9.6).
При проведении данных исследований оценивались проявления постепенной окклюзии шунта в нормальных участках коры, расположенных возле клубка и на отдалении от него; величины мозгового кровотока в областях здорового мозга рассчитывались после облитерации артериовенозного шунта на фоне отсутствия ауторегуляции, что соответствует «вазомоторному параличу» артериолярного русла. Итогом явились две основные находки. Во-первых, очень небольшое регионарное увеличение мозгового кровотока отмечалось только в сосудистом русле, характеризующемся гипотензией и прилежащим к клубку АВМ. Во-вторых, степень увеличения МК была сопоставима с клиническими проявлениями гиперемии, которая возникает при вдыхании СО2 (Young W. et al., 1990). Таким образом, фактором, нуждающимся в дальнейшем изучении, является влияние сдвигов в верхней и нижней границах ауторегуляции при наличии АВМ, что позволит дополнить результаты экспериментальных исследований (Manchola I. et al., 1993; Young W. et al., 1994) и описанного ранее имитационного моделирования (Nagasawa S. et al., 1996).
E. Gao с соавт. (1997) использовали свою модель для изучения разброса предполагаемых изменений давления в сосудистом дереве на фоне отсутствия шунта. Это производилось в целях оценки риска нарушения гемодинамики при лечении АВМ. Авторы оценивали изменения внутрисосудистого давления, скорости кровотока, биомеханической нагрузки и напряжения сдвига, которые могут иметь место при эндоваскулярном или хирургическом лечении АВМ. Использовалась имитационная модель АВМ двух размеров и бассейнов двух питающих артерий. Моделировался различный кровоток в шунте для изучения его влияния на сосудистое давление; окклюзия АВМ достигалась постепенно. Кроме того, производилась имитация проявлений системной гипертензии и гипотензии в различных сосудистых зонах.
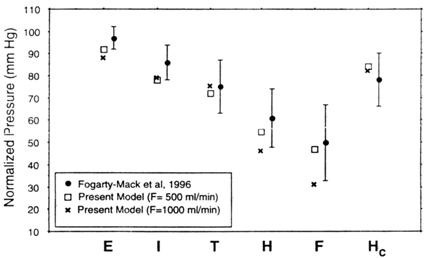
Рис. 9.6. Соотношения давления в зонах E, I, T, H, F и Нс и их сравнение с данными клинических наблюдений. Величины, прогнозируемые с помощью модели для АВМ среднего размера, близки к средним величинам экспериментальных исследований, проведенных P. Fogarty-Mac с соавт. (1996): Е — системное давление в экстракраниальной части позвоночной артерии или внутренней сонной артерии на уровне коаксиального катетера (в модели это узел 7); I — супраклиноидная часть внутренней сонной или базилярной артерий (в нашей модели это узел 11); Т — место проведения обследования с помощью транскраниального доплера (А1, М1 или Р1), в модели это узел 23; Н — условная половина расстояния между Т и питающей артерией (в модели это узел 25); F — питающая артерия (в модели это узел 90); Нс — давление в дистальных отделах контралатеральной артерии; в модели это узел 35 (Gao E. et al., 1997)
Поскольку увеличение артериального давления, имеющее место при постепенной окклюзии шунта в питающей артерии, характеризуется нелинейностью, авторы разработали и ввели понятие «процентный показатель окклюзии при давлении, равном половине его максимальной величины». Это соответствует тому проценту кровотока в АВМ, который должен быть устранен для увеличения давления в питающей артерии с базового уровня, существовавшего до лечения, до половины его предполагаемого окончательного давления после полной окклюзии шунта (рис. 9.7).
Что касается имитационной модели Е. Gao с соавт. (1997), окклюзия большой АВМ (1000 мл/мин) привела к увеличению давления в питающей артерии с 18 до 68 мм рт. ст.; показатель процентной окклюзии при росте давления до половины его максимальной величины составил 92%. При АВМ среднего размера (500 мл/мин) давление в питающей артерии возросло с 37 до 66 мм рт. ст., а величина процентной окклюзии составила 71%. Для частичного подтверждения правомерности модели изменения давления в питающей артерии, наблюдавшиеся в одном случае, сравнивались с величинами, прогнозируемыми с ее помощью. Давление измерялось во время проведения суперселективной ангиографии до и после эмболизации с помощью N-бутилцианоакрилата. Оценка процентного показателя окклюзии шунта и кровотока в нем проводилась интервенционным нейрорадиологом. Полученные данные были сходны с такими прогнозируемыми показателями кровотока в шунте, которые находились посредине между величинами, характерными для моделей АВМ среднего и большого размера.
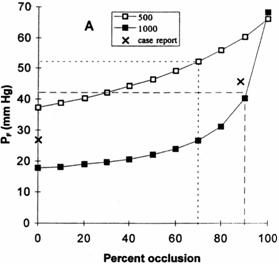
Рис. 9.7. Изменения средних величин артериального давления в питающих сосудах в процессе окклюзии двух соответствующих АВМ
Облитерация шунта привела к увеличению давления в узле АВМ и питающих артериях, однако ее влияние на проксимальные сосудистые структуры, расположенные ближе к артериальному кругу большого мозга, было незначительным. При манипулировании системным артериальным давлением наблюдался буферный эффект артериовенозного соустья; таким образом, использовались меньшие величины изменений внутрисосудистого давления в питающей артерии и давления в узле АВМ.
Средняя величина системного давления равнялась 80 мм рт. ст. При имитации производилась постепенная окклюзия АВМ с первоначальными показателями кровотока, равными соответственно 1000 и 500 мл/мин. Понятие «процентный показатель окклюзии при давлении, равном половине его максимальной величины» отражено графически в виде пунктирной линии (Gao E. et al., 1997).
Несмотря на детальное сравнение модели Е. Gao с соавт. (1997) с результатами проведенных ранее экспериментальных исследований, их работа содержит описание только одного случая как примера верификации прогнозирования на основании имитационных моделей. Тем не менее, важность работы Е. Gao с соавт. (1997) заключается, прежде всего, в создании основы для интерпретации клинических проявлений и выдвижении новых гипотез. Модель является наиболее эффективной, когда она позволяет прогнозировать величины, клиническая оценка которых либо очень трудна, либо вообще невозможна.
Модель Е. Gao с соавт. (1997) была разработана, прежде всего, для изучения влияния шунта на структуры, лежащие за пределами клубка АВМ. Более детальный анализ гемодинамики в этих структурах был предложен G. Hademenos с соавт. (1996), которые моделировали риск разрыва АВМ. Моделирование процессов внутри узла АВМ в какой-то степени затруднено отсутствием точного представления о его трехмерной архитектуре. Объединение этих двух подходов (вне- и внутриядерные структуры/весь мозг) позволяет сформировать общее представление о гемодинамике АВМ и риске кровотечения (Fischer E., 1982).
Значительное снижение перфузионного давления — распространенное явление у пациентов с АВМ; оно наблюдается в тех сосудистых бассейнах, которые обеспечивают кровоснабжение здорового мозга. При отсутствии адаптивного механизма многие из этих больных имели бы симптомы ишемии, поскольку их перфузионное давление находилось бы за пределами нижней границы кривой нормальной ауторегуляции мозгового кровотока (АРМК). Существуют доказательства, что у данных больных отмечается «адаптивный сдвиг ауторегуляции», который поддерживает мозговой кровоток выше уровня ишемии, несмотря на возможную сильную артериальную гипотензию. Этот «адаптивный сдвиг ауторегуляции» может быть объяснением того, почему ишемический неврологический дефицит, обусловленный обкрадыванием, развивается лишь у незначительного числа больных. Хотя области гипотензии и могут характеризоваться небольшим снижением кровотока, это не приводит к нарушению функции и увеличению скорости кровотока, которые можно было бы ожидать как следствие ишемической артериолярной вазодилатации. Механизм одновременного снижения мозгового кровотока, его скорости и скорости метаболизма мозга при АВМ пока еще не определен, однако важную роль могут играть диашиз и снижение массы нейронов.
Все вышесказанное важно с точки зрения прогресса в области разработки альтернативных теорий патогенеза до- и послеоперационных изменений гемодинамики мозга. Отказ от старых теорий или их пересмотр могут способствовать дальнейшему прогрессу, который мы не способны привнести сами, автоматически полагая, что каждый случай предоперационного неврологического дефицита обусловлен обкрадыванием или что отек мозга, развивающийся по необъяснимым причинам, есть следствие «перфузионного прорыва».
И, наконец, гемодинамика АВМ, по-видимому, играет важную роль в этиологии спонтанного внутричерепного кровоизлияния. Высокое трансмуральное давление в клубке ассоциируется с первоначальным проявлением кровотечения. В настоящее время происходит накопление доказательной базы, свидетельствующей о том, что поражения с выраженной артериальной гипотензией (и самым большим буферным эффектом) наименее склонны к кровотечению. Как это ни иронично звучит, но, с точки зрения понятия «обкрадывание», хроническая артериальная гипотензия мозга является не столько причиной заболеваемости, сколько предотвращающей спонтанное кровоизлияние. Это имеет прямое отношение к клинической практике, поскольку, например, большие АВМ с высоким кровотоком представляют собой подгруппу, характеризующуюся высоким риском осложнений в ходе лечения.
Полученные в модели данные согласуются с данными, полученными в эксперименте. Но в то же время в некоторых афферентных сосудах давление АВМ оказывается намного выше ожидаемого, что может быть связано с тем, что эти сосуды участвуют в кровоснабжении и нормальной паренхимы мозга. Нам представляется возможным использовать эту гипотезу для разработки способа определения функционального значения афферентных сосудов АВМ.
На рис. 9.8 представлена расчетная экспоненциальная зависимость давления в афферентных сосудах АВМ от индекса кровотока, полученная с помощью метода наименьших квадратов (Мацкевич И. П., Свирид Г. П., 1993; Семенютин В. Б. с соавт., 2006) и измеренные показатели при суперселективной катетеризации.
В 4 случаях при положительном барбитуратовом тесте ДК в афферентных сосудах было в пределах от 56 до 73 мм рт. ст., что составило от 51% до 81% от САД. Диаметр афферентных сосудов не превышал 3 мм (2,0–2,6 мм).
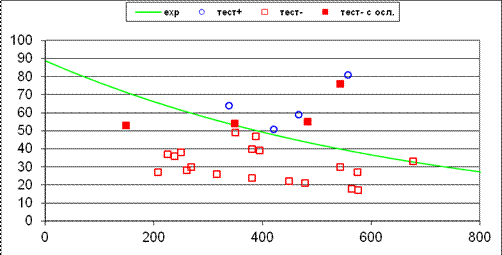
Рис. 9.8. Относительные величины ДК и расчетные значения индекса кровотока (мл/мин) в афферентных сосудах. Экспонента — зависимость ДКa от индекса кровотока, полученная после расчетов параметров на модели Е. Gao с соавт. (1997). Условные обозначения: кружки — положительный барбитуратовый тест (БТ); квадраты — отрицательный БТ; заштрихованные квадраты — отрицательный БТ с послеоперационными осложнениями (Семенютин В. Б. с соавт., 2006)
ЛСК в начальных сегментах артерии приоритетного бассейна составила 137±31 см/с. Расчетная величина индекса кровотока в этих артериях составила 446±91 мл/мин. В соответствии с расчетными величинами и результатами БТ данные афферентные сосуды частично кровоснабжали «функционально значимые» мозговые структуры. Эмболизацию АВМ через эти афферентные сосуды не проводили.
В 23 случаях БТ был отрицательным. Из них у 19 измеренное давление крови в афферентном сосуде было в пределах от 11 до 37 мм рт. ст. (23,6 ± 8,0 мм рт. ст.), что составило от 17 до 53% (32,0 ± 10,5%) от САД. В соответствии с расчетными данными, полученными на модели E. Gao с соавт., измеренная величина ДК оказалась ниже давления в эксклюзивных афферентных сосудах, кровоснабжающих только АВМ. Таким образом, во всех 19 случаях величина ДК в афферентных сосудах указывала на их низкое функциональное значение. Разброс значений ДК в афферентных сосудах возможно связан: а) с различным объемным кровотоком через исследуемые афферентные сосуды; б) с тем, что афферентные сосуды АВМ, возможно, питают и функционально незначимые зоны мозга, что подтверждается данными БТ. Проведение эмболизации АВМ (полное выключение из кровообращения компартмента АВМ через обследованные афферентные сосуды) в 18 случаях не вызвало осложнений в послеоперационном периоде. У одного больного, несмотря на отрицательный БТ и ДК в афферентном сосуде, соответствующие низкому функциональному значению, после ССЭ данного компартмента имело место осложнение, свидетельствующее о функциональном значении данного сосуда.
В 4 наблюдениях при отрицательном БТ измеренная величина ДК в афферентных сосудах превышала расчетную величину (рис. 9.8). Данные мониторинга внутричерепной гемодинамики указывали на то, что афферентный сосуд был «функционально значим»: ДК в афферентных сосудах было в пределах от 23 до 55 мм рт. ст., что составило от 33 до 76% от САД. Диаметр афферентных сосудов был в пределах 2,5–3,7 мм. Средняя ЛСК в начальных сегментах артерии приоритетного бассейна была в пределах от 96 до 152 см/с. Расчетная величина индекса кровотока в этих артериях была в пределах от 349 до 677 мл/мин. Несмотря на это, учитывая ведущее значение БТ в определении показаний для выполнения оперативного вмешательства, во всех 4 случаях была выполнена суперселективная эмболизация. Во всех случаях проведение эмболизации АВМ привело к полному выключению из кровообращения компартмента АВМ через обследованные афферентные сосуды. В раннем послеоперационном периоде (через 3–4 ч после операции) у трех из четырех больных (75%) наблюдали нарастание неврологической симптоматики в виде гемипареза, моторной афазии и гемианопсии. Развитие указанных осложнений может быть связано с влиянием анестезии или индивидуальной чувствительностью больного к барбитуратам при проведении БТ.
Следует отметить, что у одного больного без неврологических осложнений после проведения ССЭ величина ДК в афферентных сосудах незначительно превышала расчетную величину.
Средние данные регистрируемых и расчетных показателей при различных результатах БТ представлены на рис. 9.9. Средняя величина ДК в афферентных сосудах достоверно отличалась. При сравнении этого показателя в группе больных с отрицательным БТ (22,8±7,5 мм рт. ст.) с соответствующей величиной в группе больных с положительным БТ (66,0±7,4 мм рт. ст.) была выявлена наибольшая достоверность различий между ними — р < 5,1 ´ 10–9. При сравнении относительных величин этого показателя достоверность отличий была еще выше. В группе больных с отрицательным БТ ДК в афферентных сосудах было также достоверно выше (p < 0,00005) у больных с послеоперационными осложнениями (45,0±7,6 мм рт. ст.) и несущественно отличалось от величин, полученных у больных с положительным БТ (p > 0,05). Достоверных различий в расчетных величинах индекса кровотока в артериях приоритетного бассейна выявлено не было (p > 0,4).
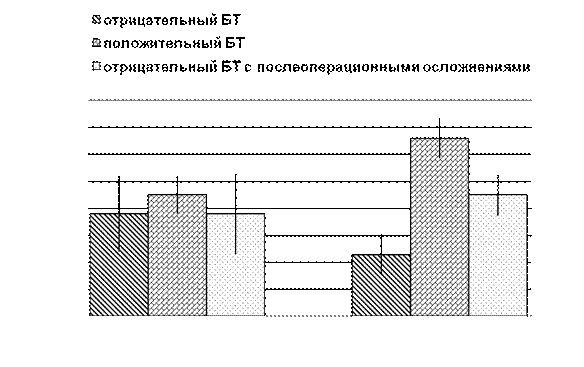
Рис. 9.9. Средние данные ДК и индекса кровотока в афферентных сосудах при различных результатах БТ
Сравнительный анализ результатов определения функционального значения афферентных сосудов АВМ по данным БТ и ДК в афферентных сосудах в системе интраоперационного мониторинга показывает, что величина ДК в афферентных сосудах по своей информативности превышает БТ. Использование ДК в афферентных сосудах для оценки их функционального значения обладает, на наш взгляд, рядом преимуществ, к которым можно отнести простое, надежное и быстрое получение количественных данных о функциональном значении афферентного сосуда АВМ, отсутствие противопоказаний при любой локализации АВМ, возможность использования на любой стадии анестезии.
Результаты дискриминантного анализа с оценкой эффективности решающих правил оценки функционального значения афферентных сосудов представлены в табл. 9.1. Определяли следующие показатели эффективности диагностики (Юнкеров В. И., Григорьев С. Г., 2002):
· чувствительность (Ч) — относительная частота отнесения истинно больного к классу больного (в нашем случае функционально значимый сосуд);
· специфичность (С) — относительная частота отнесения истинно здорового к классу здорового;
· безошибочность (Б) — относительная частота принятия безошибочных решений, как по отношению к истинно больным, так и к истинно здоровым;
· ложноотрицательный ответ (ЛО) — относительная частота отнесения истинно больного к классу здоровых;
· ложноположительный ответ (ЛП) — относительная частота отнесения истинно здорового к классу больных.
Таблица 9.1. Результаты оценки эффективности определения функционального значения афферентных сосудов (в %)
|
Способ диагностики |
Ч |
С |
Б |
ЛО |
ЛП |
|
Барбитуратовый тест (БТ) |
50,0 |
100 |
85,2 |
50,0 |
0 |
|
ДК в афферентных сосудах (ДК) |
87,5 |
94,7 |
96,3 |
12,5 |
5,3 |
|
Комбинация двух методов (БТ + ДК) |
87,5 |
100 |
96,3 |
12,5 |
0 |
Таким образом, в системе интраоперационного мониторинга внутричерепной гемодинамики величина ДК в афферентном сосуде АВМ может быть использована для оценки не только радикального выключения АВМ, но и его функционального значения. Использование системы интраоперационного мониторинга, включающей в себя измерение ДК в афферентных сосудах у больных с АВМ головного мозга различной локализации, позволяет существенно снизить количество осложнений, повышающих риск инвалидизации больных, при проведении суперселективных эмболизаций через афферентные сосуды.
Однако все же следует признать, что указанные методики оценки функционального значения афферентного сосуда АВМ являются инвазивными и могут быть использованы только при проведении эндоваскулярного вмешательства. В этой связи поиск неинвазивных методов диагностики функционального значения афферентного сосуда АВМ головного мозга в дооперационном периоде, позволяющих определять показания для проведения эндоваскулярного вмешательства, является актуальным. Одно из ключевых мест в неинвазивной оценке состояния церебральной гемодинамики занимает транскраниальная доплерография (ТКДГ).
Так, данные оценки МК с помощью ТКДГ у больных со средними и большими АВМ не подтвердили существование гипотезы феномена обкрадывания (Mast H. et al., 1995). Никакой взаимосвязи не было установлено между давлением крови и ЛСК в приводящем сосуде и неврологической симптоматикой.
R. Diehl с соавт. (1994) проводили исследование состояния вазомоторной реактивности на изменения напряжения СО2 в выдыхаемом воздухе на основе измерения ЛСК с помощью ТКДГ в магистральных внутричерепных артериях на стороне локализации АВМ и противоположной стороне у 18 больных в зависимости от типа течения заболевания. При геморрагическом типе течения вазомоторная реактивность (2,1±1,66%/мм рт. ст.) была существенно выше, чем при негеморрагическом типе (1,12±1,48%/ мм рт. ст.). Кроме того, они пришли к выводу, что относительно нормальная вазомоторная реактивность в ипсилатеральных артериях характеризует АВМ с высоким давлением в приводящих сосудах и, следовательно, с высоким риском кровоизлияния. Выраженные нарушения вазомоторной реактивности в большей степени характерны для АВМ с низким давлением в приводящих сосудах и негеморрагическим типом течения. Авторы не выявили существенных различий ЛСК в зависимости от размеров АВМ. А достоверность более выраженных нарушений цереброваскулярной реактивности (ЦВР) у больных с АВМ больших размеров по сравнению с ЦВР у больных с АВМ малых и средних размеров лишь достигала границы значимости.
L. Fleischer с соавт. (1993) проводили сравнительный анализ данных ТКДГ с давлением крови в приводящем сосуде и получили обратную корреляцию: чем ниже давление в приводящем сосуде, тем выше ЛСК. В то же время те же авторы не обнаружили взаимосвязи между частотой возникновения субарахноидального кровоизлияния в естественном течении заболевания и ЛСК, давлением крови в приводящем сосуде. Но следует отметить, что данные выводы были получены при обследовании пациентов с АВМ средних и крупных размеров.
Задача хирурга при эндоваскулярном лечении АВМ заключается в том, чтобы при осуществлении доступа установить микрокатетер на таком уровне в приводящем сосуде, когда он находится на максимально близком расстоянии от компартмента АВМ и интактные корковые артерии остаются более дистально по отношению к микрокатетеру, что обеспечивает безопасную эмболизацию без риска развития послеоперационных ишемических осложнений. В тех же случаях, когда технически решение указанной задачи невозможно, нам представляется целесообразным оценка функционального значения афферентного (приводящего) сосуда.
Использование дооперационной диагностики функционального значения приводящего сосуда АВМ на основе оценки АРМК с помощью ТКДГ особенно актуально сегодня, когда появляются новые виды эмболизатов, обязательным условием применения которых является тотальная внутривенная анестезия. Результаты измерения давления крови в приводящем сосуде могут оказаться малоинформативными в связи с изменениями системной гемодинамики во время наркоза, а полное угнетение сознания и двигательной активности делает практически невозможным применение барбитуратового теста. Между тем, дооперационная диагностика гемодинамики АВМ на основе оценки АРМК с помощью ТКДГ могла бы иметь значение для выбора тактики лечения, а именно для уточнения показаний к применению того или иного вида эмболизата, того или иного вида анестезии.
Наиболее перспективным направлением в области оценки АРМК в бассейне афферентного сосуда АВМ является кросс-спектральный анализ спонтанных колебаний показателей системной и церебральной гемодинамики. Рассчитывают фазовый сдвиг (ФС) между колебаниями САД и ЛСК в афферентном сосуде АВМ в диапазоне волн Майера (М-волн). При значениях ФС между спонтанными медленными колебаниями САД и ЛСК в афферентном сосуде АВМ в диапазоне М-волн менее 0,5 рад., что соответствует снижению скорости АРМК более чем в два раза по сравнению с нормальными значениями (1,0±0,1 рад.), констатируют низкое функциональное значение афферентного сосуда. Это свидетельствует о несущественном участии афферентного сосуда АВМ в кровоснабжении смежных областей головного мозга. Значения ФС более 0,5 рад. указывают на высокое функциональное значение афферентного сосуда АВМ в кровоснабжении мозга и на возможность развития неврологических осложнений при эмболизации компартмента АВМ из данного афферентного сосуда.
В табл. 9.2 представлены предоперационные средние значения ЛСК и скорости АРМК (ФС) в бассейне афферентного сосуда АВМ в зависимости от его функционального значения.
Таблица 9.2. Предоперационные средние значения ЛСК и ФС между М-волнами САД и ЛСК в афферентном сосуде АВМ в зависимости от функционального значения афферентного сосуда
|
Показатели |
НФЗ* (n = 60) |
ВФЗ*(n = 10) |
p |
|
ЛСК (см/с) |
175±37 |
118±42 |
P < 0,047 |
|
ФС (рад) |
0,31±0,15 |
0,71±0,17 |
P < 0,001 |
* НФЗ — низкое функциональное значение, ВФЗ — высокое функциональное значение.
Динамика различных показателей, характеризующих систему внутричерепного кровообращения при эмболизации компартмента АВМ конвекситальных отделов левой теменной доли через афферентный сосуд, имеющий низкое функциональное значение, представлена на рис. 9.10, 9.11.
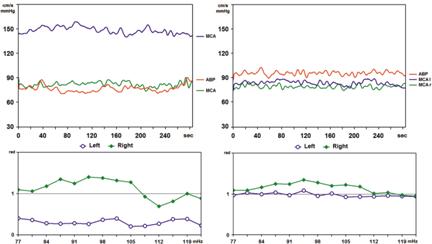
АВМ заполняется из гипертрофированных ветвей левой СМА на уровне М3–М4 сегментов (рис. 9.10, а). По данным предоперационной ТКДГ выявляется паттерн шунтирования в левой СМА с повышением ЛСК до 171 см/с, снижением пульсационного индекса до 0,38 (см. рис. 9.10, а). При кросс-спектральном анализе спонтанных колебаний САД и ЛСК выявлены нормальные значения фазового сдвига (1,2±0,1 рад.) в бассейне правой СМА и существенное его снижение (0,2±0,1 рад.) в бассейне левой СМА, участвующем в кровоснабжении АВМ (см. рис. 9.11, а).
Пациентке выполнена суперселективная катетеризация левой СМА. Микрокатетер установлен в афферентный сосуд АВМ, барбитуратовый тест отрицательный. Индекс кровотока в афферентном сосуде — 600 мл/мин, давление крови в нем — 30 мм рт. ст., что составило 32% от САД (93 мм рт. ст.). Афферентный сосуд расценен как функционально незначимый, после чего произведена эмболизация компартмента АВМ гистоакрилом.
При контрольной ангиографии АВМ не контрастируется (рис. 9.10, б). Нарастания неврологической симптоматики не отмечено. В послеоперационном периоде отмечалось изменение паттерна шунта в виде снижения ЛСК в левой СМА до 94 см/с и повышения пульсационного индекса до 0,64 (см. рис. 9.10, б). По данным кросс-спектрального анализа спонтанных колебаний САД и ЛСК на стороне АВМ отмечалось повышение ФС до 0,8±0,2 рад. (рис. 9.11, б), что свидетельствует о существенном повышении скорости АРМК в бассейне левой СМА после проведенной внутрисосудистой операции (см. рис. 9.11, б).
Результаты оценки состояния АРМК у пациентки c АВМ левой височной доли и высоким функциональным значением афферентного сосудов представлены на рис. 9.12, 9.13. АВМ заполняется из гипертрофированных ветвей левой СМА на уровне М2–М3 сегментов (рис. 9.12, б). По данным предоперационной ТКДГ выявлялся паттерн шунтирующего процесса в левой СМА, что проявлялось снижением пульсационного индекса до 0,72, ЛСК (72 см/с) — в пределах нормы (см. рис. 9.12, б). В правой СМА ЛСК была также в пределах нормы (52 см/с), ПИ умеренно снижен до 0,72.
При кросс-спектральном анализе спонтанных колебаний САД и ЛСК в диапазоне М-волн (рис. 9.13) установлены нормальные значения фазового сдвига в правой СМА (1,1±0,1 рад.) и умеренное его снижение в левой СМА (0,7±0,1 рад.), участвующем в кровоснабжении АВМ, что свидетельствует о высоком функциональном значении афферентного сосуда АВМ в бассейне левой СМА.
Во время операции микрокатетер был установлен в афферентном сосуде АВМ в бассейне левой СМА. Барбитуратовый тест положительный, что проявлялось развитием преходящей очаговой неврологической симптоматики. Поток крови в афферентном сосуде 280 мл/мин. Давление крови в афферентном сосуде 48 мм рт. ст., что составило 51% при САД 95 мм рт. ст. Афферентный сосуд расценен как «функционально значимый», и от эмболизации АВМ решено было воздержаться.
|
|
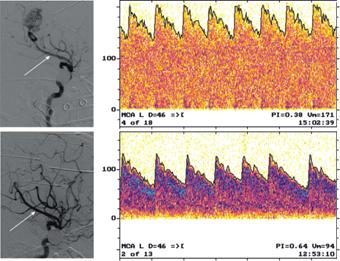
Рис. 9.10. Левосторонняя каротидная ангиография и спектр ЛСК в афферентном сосуде АВМ левой теменной доли до (а) и после (б) эндоваскулярного вмешательства
|
|
||||
Рис. 9.11. Билатеральный мониторинг и фазовый сдвиг между М-волнами ЛСК и САД на стороне АВМ левой теменной доли и противоположной стороне до (а) и после (б) оперативного вмешательства
|
|
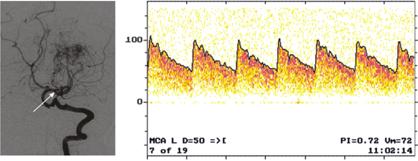
Рис. 9.12. Левосторонняя каротидная ангиография (а) и спектр ЛСК в афферентном сосуде АВМ подкорковых ганглиев левой височной доли (б)
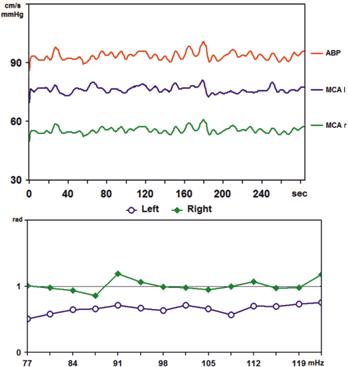
Рис. 9.13. Билатеральный мониторинг и фазовый сдвиг между М-волнами ЛСК и САД на стороне АВМ медиальных отделов левой лобной доли и противоположной стороне
Таким образом, высокое функциональное значение афферентного сосуда АВМ левой теменной доли было диагностировано неинвазивно путем оценки скорости АРМК в его бассейне на дооперационном этапе.
Предоперационная оценка функционального значения афферентного сосуда АВМ позволяет решить также проблему анестезиологического обеспечения в ходе проведения эндоваскулярного вмешательства, которая заключается в следующем. Исходя из принципов анатомической доступности и физиологической дозволенности, сформировалось два основных направления эндоваскулярных вмешательств при церебральных АВМ. Сторонники первого направления, так называемой «анатомической школы» (Young W. L. et al., 1994; Manninen P. et al., 1995; Luginbuhl M. et al., 1997; Ogilvy C. et al., 2001), пропагандируют эмболизацию АВМ, основанную на знании нейроанатомии и ангиоархитектоники сосудов головного мозга без предварительного определения функционального значения афферентного сосуда АВМ, и в связи с этим отдают предпочтение проведению операции в условиях тотальной внутривенной анестезии. Кроме того, она является обязательной при использовании современных эмболизатов. Сторонники второго направления, так называемой «физиологической школы» (Maldjian J. et al., 1996; Lazar R. et al., 1997), в связи с широкой вариабельностью функциональной зоны головного мозга, которая не всегда совпадает с анатомической, в особенности у больных с АВМ, поддерживают идею интраоперационной оценки функционального состояния головного мозга в зоне локализации АВМ с помощью различных тестов перед проведением эмболизации в условиях седации-анальгезии. На наш взгляд, второй подход является более обоснованным и безопасным, так как позволяет в большей степени соблюдать основополагающие принципы хирургии и, в конечном счете, достигать эффективных результатов при сохранении качества жизни пациентов. В этой связи метод диагностики функционального значения на основе предоперационной диагностики состояния АРМК в сосуде, участвующем в кровоснабжении АВМ, мог бы стать ключевым звеном в объединении позиций обеих школ, вооружив представителей «анатомической школы» знаниями «физиологической школы» с целью проведения более безопасной эмболизации и предупреждения возможных неврологических осложнений во время эндоваскулярных вмешательств АВМ головного мозга в условиях тотальной внутривенной анестезии.
В последние годы в литературе появляются работы, иллюстрирующие расширяющиеся возможности ультразвуковой визуализации сосудов головного мозга на основе дуплексного и триплексного сканирования (Klötzsch C. et al., 1995; Bartels E., 2005), которые в скором времени не будут уступать по своей информативности дорогостоящим методам: магнитно-резонансной и дигитальной ангиографии. В этой связи поиск способов сочетанного применения ТКДГ-мониторинга с ультразвуковой визуализацией исследуемого сосуда в одном доплеровском приборе, разработка программ кросс-спектрального анализа медленных колебаний в режиме on-line позволят перейти на качественно новый технический уровень изучения АРМК и проводить более точную диагностику функционального значения афферентного сосуда АВМ неинвазивным и безопасным способом.
Следующая глава:
Литература
Предыдущая глава:
Микрохирургическое удаление
